Desnitrificación, sulfato reducción y metanogénesis durante la biomineralización de aguas residuales de la industria farmacéutica
RESUMEN
El objetivo de éste trabajo fue investigar la interrelación de las actividades biológicas responsables de la degradación de los diferentes compuestos orgánicos e inorgánicos presentes en el agua modelo representativa de una agua residual generada por la industria farmacéutica. Se estudió la influencia de la concentración del iones sulfato, pH y temperatura sobre el proceso de desnitrificación, sulfato reducción y metanogénesis, con el fin de establecer parámetros óptimos para la digestión anaerobia de una agua residual generada por la industria productora de antibióticos. Los resultados obtenidos muestran que a concentraciones menores de 1 g/l del ión sulfato no hay efecto negativo sobre la desnitrificación y la metanogénesis, el pH óptimo para las tres reacciones de interés fue de 7.0; la desnitrificación es eficiente en el rango de pH de 6.0 hasta 8.5 lográndose un 100% de eficiencia remoción a diferentes tiempos de reacción, la sulfato reducción y la metanogénesis son efectúan mejor en el rango de pH de 6.0 a 7.0; los tres procesos se manifestaron claramente en el rango de temperatura de 25 a 40 °C, sin embargo la temperatura óptima para los tres casos fue 37 °C.
INTRODUCCIÓN.
Las aguas residuales de la industria farmacéutica contienen en su mayoría altas concentraciones de compuestos orgánicos, sulfatos, nitratos y otros. Para el tratamiento de éste tipo de aguas residuales han sido ampliamente utilizados los procesos anaerobios (6).
La concentración excesiva de nitrato en las aguas residuales sin tratar también vertidas a lugares donde existen tomas de agua para el consumo de seres humanos resulta muy peligroso, ya que el nitrito se combina con la hemoglobina causando metahemoglobinemia y cianosis en recién nacidos, otro gran problema del nitrato es ser un causante de la eutroficación. El sulfato presente en las aguas en si no es tan tóxico como el sulfuro de hidrógeno que es la forma más tóxica, ya que el aumento de las emisiones en forma de gas de este compuesto daña a la atmósfera al mezclarse con otros gases existentes en la misma, a su vez formando aún compuestos más tóxicos, aparte de ser un compuesto de olor desagradable y ser un compuesto bastante corrosivo y deteriora las conducciones de alcantarillado. Por tanto son varios problemas que se deben remediar para que esta agua de aspecto y olor desagradable no lleguen a dañar nuestros ecosistemas. Las reacciones químicas de interés en esta investigación se dan a continuación:

METODOLOGÍA.
La digestión anaerobia fue desarrollada en reactores batch con capacidad de 120 ml con un volumen total de fase líquida de 40 ml incluyendo 10 ml de lodo granular sulfidogénico.
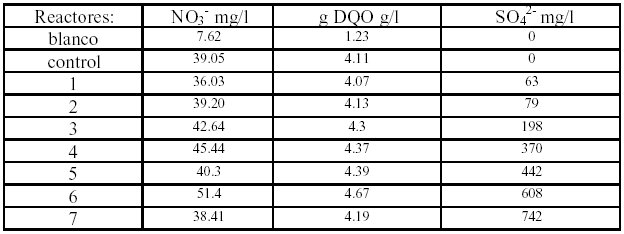
Para estudiar la influencia del ion sulfato sobre la desnitrificación y la metanogénesis se llevaron a cabo ocho experimentos por duplicado, diluyendo cada substrato en 20 ml de medio mineral con la siguiente composición en g/l; 0.5 NaHPO42H2O; 0.3 NH4Cl; 0.1 MgCl22H2O; 0.08 CoCl26H2O; 0.2 NiCl2; 0.001 ZnCl2. El pH fue ajustado a 7.5, temperatura de 37 °C, en calidad de fuente de carbono se utilizó acetato de amonio con concentración prácticamente constante y se presenta en forma de DQO, la concentración de nitrato también permaneció constante, lo única variante fue la concentración del ión sulfato, todas las reacciones se moni torearon y compararon con respectó a un reactor considerado como blanco, que solo tenia consorcio bacteriano y un reactor control que se le añadió únicamente la fuente de carbono (Tabla 1).
Tabla 1. Concentraciones utilizadas en el estudio de la influencia del ión sulfato sobre la desnitrificación y metanogénesis.
La formación de CH4 fue monitoreada en un cromatógrafo de gases Varian 3400; El D.Q.O. total se determinó como se describe en American Public Health Association 1971(2). El NO3 – se midió mediante la técnica del ácido homotrópico; el consumo de SO4 2- se determino como se describe en (1); la formación de H2S fue monitoreada como se describe en American Public Health Association 1992 (3).
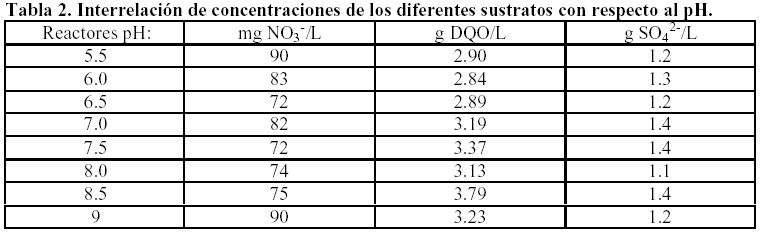
En la realización de experimentos a diferentes pH la metodología fue la misma. La concentración de nitrato se mantuvo constante en el orden de 80 mg/l, sulfato 1.25 mg/l y donador de protones 1.25 g/l de DQO y solamente variando pH en un rango de5.5, 6.0, 6.5, 7.0, 7.5, 8.0, 8.5, 9.0 .
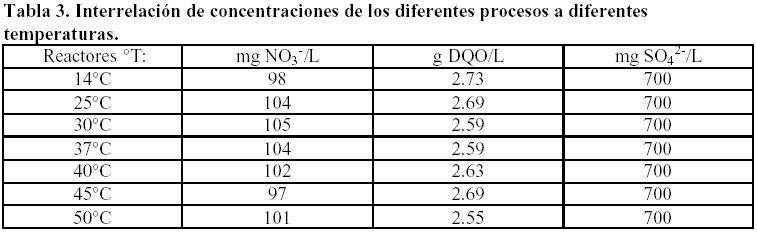
En la realización de los experimentos a diferentes temperaturas la metodología fue la misma, trabajándose en los tres diferentes rangos de temperatura: psicrófila, mesófila y termo fila, (Tabla 3):
RESULTADOS Y DISCUSIÓN.
Influencia de la concentración del ión sulfato
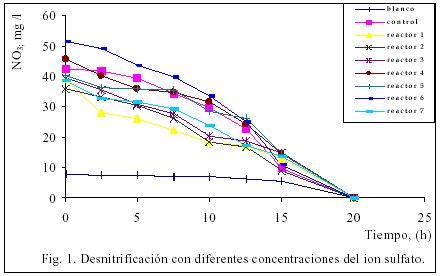
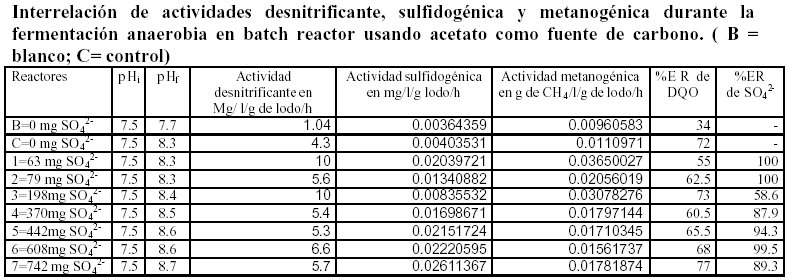
Las cinéticas de consumo de nitrato, formación de H2S y CH4 se presentan en las figuras 1, 2 y 3 respectivamente, cabe mencionar que el proceso de desnitrificación no se ve influenciado a diferentes concentraciones de ión sulfato, se pude considerar que de los tres procesos, la desnitrificación es el más eficiente, ya que en el trascurso de 24 horas se efectúa completamente independientemente de la concentración de sulfato presente en el sistema reaccionante, la formación de H2S se presento después de las 200 horas de reacción, esto probablemente a que en la competencia por el donador de protones las bacterias desnitrificantes fueron más eficientes que las sulfato reductoras, las bacterias metano génicas fueron las últimas en aparecer en el escenario, comprobándose que en un sistema donde se presentan las tres actividades estudiadas, la desnitrificación resulta ser la primera en aparecer, esto también pude estar relacionado con la afinidad del donador de protones. En la tabla 4 se muestran las actividades de los tres procesos, en esta podemos definir que la actividad denitrificante prácticamente no cambia se mantiene en el orden de 5.5 mg /l /g SVS/h de NO3, en cambio la actividad sulfidogénica si cambia cuando aumenta la concentración de sulfato y la actividad metanogénica alcanza un óptimo cuando la concentración del ión sulfato es de aproximadamente de 80 mg/l, por arriba de esta concentración la metanogénesis disminuye lentamente, la ER de DQO bajo estas condiciones es de aproximadamente de un 80%, esta información se deba prácticamente a la desnitrificación y sulfatoreducción, el retardo de este último proceso probablemente este asociado con la mayor capacidad de las bacterias desnitrificantes ver reacciones 2, 4 y 5 (referencia).
NO3; mg /l
H2S; mg /l
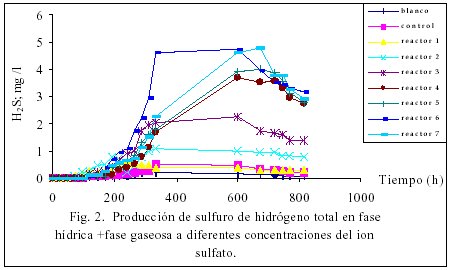
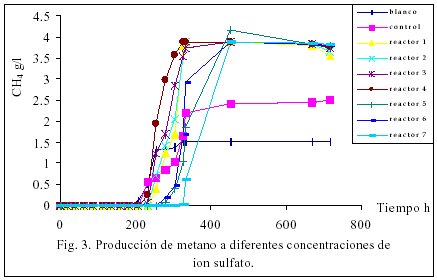
Influencia del pH
Los estudios relacionados con la influencia del pH mostraron claramente que la desnitrificación pésimamente se efectúa a pH de 5. 5 y 9.0, lo mismo ocurre con la sulfidogénesis, la metanogénesis en función de diferentes pH mostró los mejores resultados en el rango de 6 – 8 a pH de 5.5; 8.5 y 9 prácticamente metano no se formó (reacciones 4, 5 y 6). La actividad desnitrificante se mantiene constante en el rango de 6.5 – 8.5, en cambio la actividad sulfidogénica permanece constante, la metanogénica disminuye a pH de 8.5 y 9 Tabla 5.
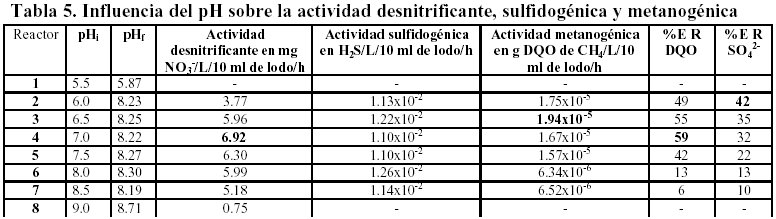
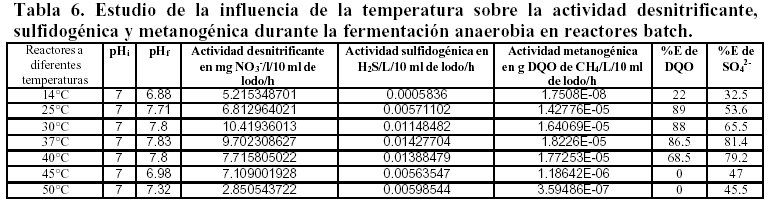
Influencia de la temperatura.
La desnitrificación es el proceso que tolera un rango de temperatura más amplio de 25 a 45°C y la sulfidogénesis es más favorable de 30 – 37°C, en cambio la metanogénesis expresa sus mejores resultados en un rango termófilo más amplio de 30 – 40°C. Tabla 6.
CONCLUSIONES.
Los resultados obtenidos indican que el pH y la temperatura juegan un papel importante para la expresión de las diferentes actividades biológicas del lodo anaerobio, cuando el pH y la temperatura salen de los límites aceptados para la desnitrificación, sulfidogénesis y metanogénesis; la concentración del ión sulfato con concentraciones inferiores a 1 g/l el efecto sobre la desnitrificación es prácticamente nula solo para el caso de la metanogénesis es mas notoria la influencia del ión sulfato.
Jesús Rodríguez Martínez *; Silvia Yudith Martínez Amador ; Yolanda Garza García . Departamento de Biotecnología, Facultad de Ciencias Químicas, Universidad Autónoma de Coahuila