Control del crecimiento de organismos filamentosos en una planta de tratamiento de aguas residuales industriales
Se identificaron los principales microorganismos filamentosos en los efluentes de aguas residuales de tres empresas del giro de alimentos, ubicadas en la Zona Industrial Toluca – Lerma; dichas descargas son conducidas a una planta de tratamiento de aguas residuales industriales (PTARI), cuyo proceso de lodos activados se ha visto afectado por la presencia de microorganismos filamentosos, los que han sido identificados a la entrada de la planta y en la etapa de recirculación. Los microorganismos filamentosos que predominaron en los efluentes de las empresas fueron: Tipo 1863, Tipo 021N, Tipo 0211, Nostocoida limicola II, Thiothrix I y II, y el Tipo 0411; mientras que en la entrada a la planta de tratamiento, además de prevalecer los anteriores microorganismos, aparecen el Tipo 0092, Tipo 0701, Tipo 0041 y Gallionella; y durante la recirculación de los lodos, no solamente se identificaron a los microorganismos mencionados en la entrada, sino que también Microthrix parvicella (como el principal y de manera abundante), Tipo 1701 y el Tipo 0914. Se concluye que el microorganismo filamentoso que afecta el proceso de lodos activados se debe principalmente, por el crecimiento de M. parvicella, generado en la etapa de recirculación del proceso, debido a variaciones estacionales y condiciones de operación de la planta de tratamiento.
Palabras Clave: lodos activados, floculación, filamentosos, esponjamiento.
INTRODUCCIÓN
En un proceso de tratamiento de aguas residuales por lodos activados, los factores principales que intervienen en la formación del flóculo y su sedimentación son: edad de los lodos, toxicidad (presencia de metales pesados y compuestos orgánicos), descargas de lodos, actividad abundante de los protozoarios ciliados, excesivo esfuerzo cortante, excesiva cantidad de tenso activos ó surfactantes. De manera reciente, se ha mostrado que la floculación resulta de la producción de una capa de polisacárido pegajoso, el cual hace que los organismos se adhieran; otros factores, tales como la superficie química y densidad del flóculo pueden influenciar fuertemente las propiedades de sedimentación (Eikelboom et al., 1998). Además, la geometría del sistema y la forma en que el agua residual se aporta al reactor condicionan las características de floculación del lodo (Ramalho, 1996).
No todas las bacterias que se desarrollan en los lodos activados son formadoras de flóculos, ya que otros organismos, como los de tipo filamentoso pueden desarrollarse, causando problemas de operación y de calidad del agua tratada (Richard, 1991).
La condición que en ocasiones se presenta, por la que el lodo es ligero o inflado y por ello, difícil de sedimentar, se denomina esponjamiento (bulking, en inglés). El lodo de estas características pasa por encima de los vertederos de separación y se escapa con el efluente del clarificador secundario, lo que provoca que la concentración de sustrato presente en el sistema sea insuficiente para mantener el crecimiento de los microorganismos que constituyen el lodo; por lo tanto, los microorganismos se ven obligados a funcionar en régimen de respiración endógena y el efluente tendría una Demanda Bioquímica de Oxígeno (DBO) relativamente elevada, lo que no resulta deseable (Ramalho, 1996; Pacheco et al., 2000).
Durante el proceso de respiración endógena, se metaboliza un material citoplasmático rico en proteínas y ácido ribonucleico (ARN); el residuo está constituido principalmente por cápsulas celulares muy ligeras que se resisten a la sedimentación. Esta es la razón por la cual, las relaciones bajas de F/M (alimento/microorganismo) hacen que el lodo tenga unas características muy pobres de decantación (flóculos dispersos); mientras que a relaciones de F/M elevadas (por ejemplo, superiores a 0.6 – 1.0 kgDBO/kgSSTLM/d) predominan un tipo de microorganismos de naturaleza filamentosa, provocando un lodo inflado, que impide la sedimentación al permanecer en suspensión casi continuamente (Ramalho, 1996).
Los filamentosos no se desarrollan ni crecen en lodos jóvenes; cuando la edad del lodo se incrementa, los microorganismos filamentosos cortos empiezan a desarrollarse dentro de las partículas del flóculo. Las bacterias formadoras del flóculo, floculan con los microorganismos filamentosos de diferentes longitudes, estos últimos proveen una resistencia a la acción cortante del medio y permite un incremento significativo en el número de bacterias formadoras de flóculos, afectando la sedimentación. Las partículas floculadas incrementan su tamaño y cambian de laforma esférica a irregular (Ramalho, 1996; Eikelboom et al., 1998).
El crecimiento de los filamentosos depende en gran medida, de las condiciones de operación de la planta de tratamiento, tales como: concentración de Oxígeno Disuelto (OD) baja, relación F/M alta, deficiencia de Nutrientes (Nitrógeno y Fósforo), pH bajo, temperatura, carga orgánica baja, DBO residual soluble, composición del agua residual (altas en grasa y aceites), mayores tiempos de retención celular (Jenkins et al., 1993).
Los microorganismos filamentosos se identifican rutinariamente sobre la base de sus características morfológicas y reacciones de varios procedimientos de tinción, siguiendo los métodos detallados en los Manuales de Eikelboom y van Buijsen y el de Jenkins et al. (1993); y más recientemente, por métodos biológicos, empleando su secuencia de 165 rDNA para determinar sus relaciones filogenéticas (Bradford et al., 1998).
Diversos casos de sistemas de tratamiento de aguas residuales que han presentado problemas con desarrollo de microorganismos filamentosos, utilizan cloro para controlar el crecimiento de los mismos; sin embargo, es un método costoso y que además, elimina microorganismos formadores de flóculo al igual que a los filamentosos (Jenkins et al., 1993).
OBJETIVO
Identificar la procedencia de microorganismos filamentosos y su correlación con las variables de operación del proceso de lodos activados a fin de controlar la presencia y desarrollo de estos microorganismos y obtener una calidad de agua adecuada (que cumpla con la normatividad para descarga en cuerpo de agua (NOM 001-ECOL-1996).
METODOLOGÍA
Recolección y manejo de muestras
Del total de empresas afiliadas a la planta de tratamiento de aguas residuales industriales (144), y de acuerdo a su perfil de contaminantes, se consideraron los efluentes del giro de alimentos, seleccionando tres, mismos que representan alrededor de la mitad del flujo volumétrico total que capta la planta de tratamiento; cabe mencionar que cada una de las empresas seleccionadas (producción de levadura, panificación y frituras de maíz) descarga sus aguas residuales con un pretratamiento, en los tres casos, biológico.
Técnicas de identificación de microorganismos filamentosos
La identificación de los filamentosos (análisis cualitativo) se realizó mediante el examen microscópico de sus características morfológicas y reacciones de tinción, siguiendo los métodos detallados en el Manual de Jenkins et al. (1993).
Evaluación de las condiciones de operación y diseño de la planta de tratamiento de aguas residuales industriales (PTARI)
Durante el período de octubre de 2000 a enero de 2001 se realizaron determinaciones del Índice Volumétrico de Lodos (IVL), la relación F/M, Oxígeno Disuelto (OD), Tiempo de Retención Hidráulico (TRH), Tiempo de Retención Celular (TRC), pH (en la entrada al tanque de aeración), Sólidos Suspendidos Volátiles (SSV) y Totales (SST), así como la eficiencia del tratamiento con respecto a la Demanda Bioquímica de Oxígeno (DBO) y Demanda Química de Oxígeno (DQO).
RESULTADOS
Los resultados de la identificación de los microorganismos filamentosos se concentran en la Tabla 1, donde se puede apreciar durante los cuatro meses de estudio, la incidencia de los microorganismos Tipo 0211, Tipo 1863, Thiothrix II y N. limicola II en la entrada a la planta de tratamiento y cuya presencia, coincide con los microorganismos filamentosos identificados en los tres efluentes de las industrias, a excepción de N. limicola II que no está presente en la industria de la panificación. Con respecto a la fase de la recirculación de lodos activados, considerada como una operación de la planta, ya que se recircula un determinado porcentaje de SSV con el fin de mantener constante la cantidad de microorganismos en el reactor aerobio, se encontró que el microorganismo filamentoso dominante es Microthrix parvicella, además de identificarse al Tipo 1701, Tipo 0914 y Tipo 0092; este último, de acuerdo a estudios realizados por Richard (1991) se encuentra comúnmente comúnmente asociado a M. parvicella en el proceso de lodos activados.
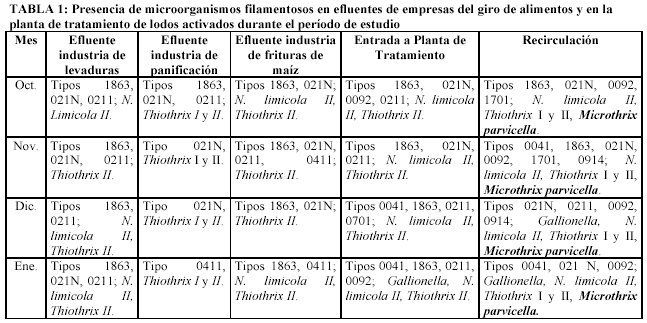
Con respecto a las condiciones de operación y diseño de la planta de tratamiento de aguas residuales industriales (PTARI), la Tabla 2 concentra los valores de los parámetros determinados, además se reporta la eficiencia de remoción del proceso de acuerdo a DQO y a DBO, siendo de entre 37 – 45% y de 80 – 87%, respectivamente.
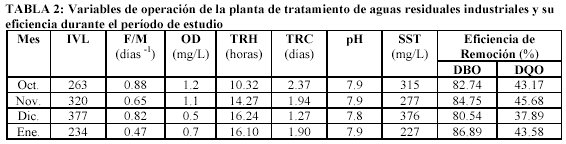
Los anteriores parámetros se correlacionaron con la presencia de los microorganismos filamentosos identificados en la entrada a planta y en la recirculación de los lodos; apreciándose que los valores de F/M se encuentran dentro del rango de 0.47 a 0.88 días -1 y los de IVL, están comprendidos entre 234 y 377; los cuales indican la presencia de esponjamiento provocado por microorganismos filamentosos. Ramalho (1996) reporta como valores óptimos de la relación F/M los comprendidos entre 0.3 a 0.6; asimismo los valores típicos de IVL con características apropiadas de sedimentación están comprendidos dentro del intervalo de 35 – 150.
Como se observa en la Tabla 2, las concentraciones de Oxígeno Disuelto (OD) oscilan en un intervalo de 0.5 a 1.2 mg/L, lo cual también es determinante en el crecimiento de microorganismos filamentosos. Al respecto, los estudios de Scruggs y Randall (1998) en reactores de flujo continuo a escala laboratorio e industrial sugieren que la concentración de oxígeno disuelto (OD) y la relación F/M son los factores clave que afectan el crecimiento de varios tipos de filamentosos presentes en un sistema de tratamiento de lodos activados de aguas residuales industriales.
En cuanto al Tiempo de Retención Hidráulico (TRH), se aprecian valores que superan las 8 horas que normalmente se emplean en los procesos típicos de lodos activados, lo cual representa mayores requerimientos de aireación; asimismo, los datos del Tiempo de Retención Celular (< 5 días) indican que los lodos son difíciles de sedimentar y aparecen los filamentosos (Metcalf & Eddy, 1996).
En este estudio, es de notarse la presencia de Microthrix parvicella, microorganismo identificado de manera abundante en la etapa de recirculación, asociado a una baja concentración de oxígeno y un alto Tiempo de Retención Celular, además la relación F/M es mucho mayor que la recomendada por Ramalho.
La presencia abundante y frecuente de Microthrix parvicella en plantas de lodos activados y, principalmente en la etapa de recirculación ha sido estudiada por diversos autores. Su ocurrencia indica que el microorganismo tiene la habilidad suficiente de consumir sustratos no degradables, como el ácido oleico, palmítico y triglicéridos, – por ejemplo, efluentes de industrias de frituras de maíz -; no consumiendo los más simples (acético, etanol, glucosa, entre otros); y bajo condiciones aerobias o anaerobias (Andreasen y Nielsen, 1998; Mamais et al., 1998). Su excesivo crecimiento es favorecido a altos tiempos de retención en los clarificadores secundarios, que permiten además, la producción de ácidos grasos volátiles en la recirculación de lodos activados (degradación anaerobia), influyendo también, la profundidad de los clarificadores (Hagland et al., 1998).
Tandoi et al. (1998) describe a Microthrix parvicella como un organismo aeróbico; con capacidad de crecer a concentraciones bajas de Oxígeno Disuelto; de crecimiento lento; que exhibe versatilidad nutricional, ya que emplea compuestos simples y complejos como fuente de carbono, nitrógeno y fósforo. Además utiliza su capacidad de reducir nitrato a nitrito como mecanismo de sobrevivencia en la zona anóxica. En condiciones anaerobias (ausencia de oxígeno disuelto y de nitrato) utiliza como estrategia la hidrólisis de gránulos de polifosfato que almacena dentro de la célula (Dillner Westlund et al., 1998; Mamais et al., 1998).
En sus trabajos de investigación, Knoop y Kunst (1998), encontraron que el crecimiento óptimo de Microthrix parvicella en lodos activados, se induce en temperaturas bajas (< 12 a 15 ºC) y cargas bajas de DBO5 (< a 0.1 Kg/Kg d). Asimismo, Eikelboom (1998) y Rothman (1998), observaron que dicho microorganismo muestra un patrón estacional con un máximo en invierno (lo cual coincide con el período de estudio) y un mínimo durante verano.
Además, diversas investigaciones señalan a Microthrix parvicella como el microorganismo principal responsable de los problemas de separación de sólidos, por esponjamiento y formación de espuma en los sistemas de lodos activados, debido principalmente a su naturaleza hidrofóbica (Andreasen y Nielsen, 1998; Knoop y Kunst, 1998; Mamais et al., 1998; Tandoi et al., 1998).
CONCLUSIONES
La presencia de varios filamentosos en industrias específicas, como producción de levadura, panificación y frituras de maíz, se puede atribuir a la composición del agua residual por sus distintos tipos de manufactura; que por lo general contienen sustratos metabolizables (glucosa, lactosa, maltosa) y altos contenidos en grasas y aceites, lo cual promueve el crecimiento de los microorganismos filamentosos, como el Tipo 1863, Tipo 021N, Tipo 0211 y Thiothrix II, principalmente.
Los microorganismos filamentosos son afectados por las características de los influentes y las condiciones de operación de la planta de tratamiento. De acuerdo a los microorganismos filamentosos encontrados en la etapa de recirculación del tren de tratamiento de agua residual industrial, se concluye que es el punto en el cual se genera Microthrix parvicella, microorganismo asociado a una baja concentración de oxígeno y un alto Tiempo de Retención Celular, además la relación F/M es mucho mayor que la recomendada por Ramalho.
El desarrollo de M. parvicella en la etapa de recirculación, puede ser debido a factores como baja DBO, ya que el proceso la consume en un 80% en promedio, dejando una concentración alta como DQO, que está indicado como sustrato de mayor complejidad que puede metabolizar un microorganismo como M. parvicella. Asimismo, la cantidad de oxígeno disuelto (0.5 a 1.2 mg/L) es una concentración baja que favorece su crecimiento, considerando que en la etapa de recirculación que es inmediata la sedimentación, la concentración de oxígeno disuelto es nula.
Efectuando cambios en la etapa de recirculación (parámetros de control) se debe eliminar el crecimiento de M. parvicella; como es, reduciendo el gasto de recirculación para no alimentar al microorganismo con el alimento rico en material difícil de degradar (alta carga de material medido como DQO con respecto a una baja carga como DBO).
En el caso de sólidos suspendidos totales a la salida de la planta, nos indica que están por arriba de la normatividad, considerando agua para uso agrícola (150 mg/L), esto es debido a la presencia de microorganismos filamentosos en el proceso.
Agradecimientos
Los autores agradecemos el apoyo y las facilidades brindadas por el Ing. Clemente de Jesús Avila González, Gerente de la Planta de Tratamiento de Aguas Residuales Industriales, en la realización de la presente investigación.
REFERENCIAS BIBIOGRÁFICAS
American Public Health Association (APHA), American Water Works Association (AWWA), Water Pollution Control Federation (WPCF). (1989). Standard Methods for the Examination of Water and Wastewater. 17ª. ed. APHA. USA.
Andreasen, K. and Nielsen, P. H. (1998). In situ characterization of substrate uptake by Microthrix parvicella using microautoradiography. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 19 – 26.
Bradford, D., Christensson, C., Jakab, N. and Blackall, L. L. (1998). Molecular biological methods to detect «Microthrix parvicella» and to determine its abundance in activated sludge. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 37 – 45.
Colín C., A. (2000). Estudio Integral de la Operación de la Planta de Tratamiento de Aguas Residuales Reciclagua. Informe Final. Proyecto de Investigación Clave 1431/2000. Facultad de Química, UAEM. pp 1 – 28.
Daigger, G. T., Buttz, J. A. (1998). Upgrading Wastewater Treatment Plants. 2ª. ed. Water Quality Management Library.
USA. Vol. 2. 243 p.
Dillner Westlund, A. Hagland, E. and Rothman, M. (1998). Foaming in anaerobic digesters caused by Microthrix parvicella. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 51 – 55.
Eckenfelder, W. (2000). Industrial Water Pollution Control. 3ª. ed. McGraw Hill. Singapur. 584 p.
Eikelboom, D. H. and Grovenstein, J. (1998). Control of bulking in a full scale plant by addition of talc (PE 8418). En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 297 – 301.
Eikelboom, D. H., Andreadakis, A. and Andreasen, K. (1998). Survey of filamentous populations in nutrient removal plants in four European countries. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 281 – 289.
Goodfellow, M., Stainsby, F. M., Davenport, R., Chun, J. and Curtis, T. (1998). Activated sludge foaming: the true extent of actinomycete diversity. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 511 – 519.
Hagland, E., Dillner Westlund, A. and Rothman, M. (1998). Sludge retention time in the secondary clarifier effects on the growth of Microthrix parvicella. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. By The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 47 – 50.
Henry, J. G., Heinke, G. W. (1997). Ingeniería Ambiental. 2ª. ed. Prentice Hall. México. Vol. 1 y 2. 778 p.
Jáuregui R., B. (2000). Identificación de microorganismos filamentosos. Convenio General de Colaboración Reciclagua – Facultad de Química. Facultad de Química, UAEM.
Jenkins, D., Richard, M. G. y Daigger, G. T. (1993). Manual on the Causes and Control of Activated Sludge Bulking and Foaming. 2ª. ed. Lewis Publishers. USA.193 p.
Jorand, F., Boué-Bigne, F., Block, J. C. and Urbain, V. (1998). Hydrophobic / hydrophilic properties of activated sludge exopolymeric substances. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 307 – 315.
Knoop, S. and Kunst, S. (1998). Influence of temperature and sludge loading on activated sludge settling, especially on Microthrix parvicella. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 27 – 35.
Lacko, N., Bux, F. and Kasan, HC. (1999). Survey of filamentous bacteria in activated sludge plants in KwaZulu-Natal. Water SA. Vol. 25 No. 1. pp. 63 – 68.
Mamais, D., Andreadakis, A., Noutsopoulos, C. and Kalergis, C. (1998). Causes of, and control strategies for, Microthrix parvicella bulking and foaming in nutrient removal activated sludge systems. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 9 – 17.
Metcalf & Eddy. (1996). Ingeniería de Aguas Residuales. Tratamiento, Vertido y Reutilización. McGraw Hill. México. Tomo 1 y 2. 1485 p. (Traducido de la 3ª. ed. en inglés de Wastewater Engineering. Treatment, Disposal Reuse).
Pacheco S., V. F., Pavón S., T. B. y Jáuregui R., B. (2000). Proyecto sobre microorganismos filamentosos. Convenio
General de Colaboración Reciclagua – Facultad de Química. Facultad de Química, UAEM. pp 1 – 47.
Ramalho, R. S. (1996). Tratamiento de Aguas Residuales. Reverté. México. 705 p.
Richard, M. (1991). Activated Sludge Microbiology. The Water Pollution Control Federation. USA. 73 p.
Rothman, M. (1998). Operation with biological nutrient removal with stable nitrification and control of filamentous growth. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 549 – 554.
Scruggs, C. E. and Randall, C. W. (1998). Evaluation of filamentous microorganism growth factors in an industrial wastewater activated sludge system. En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. By The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 263 – 270.
Sepúlveda V., H. J. (1998). Treatment of Industrial Wastewaters: EPCCA Case. Roundtable on Municipal Water. Canadá. (Inter-American Program for Environmental Technology Cooperation in the Key Industry Sectors).
Stratton, H., Seviour, B. and Brooks, P. (1998). Activated sludge foaming: what causes hydrophobicity and can it be manipulated to control foaming? En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. By The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 503 – 509.
Tandoi, V., Rossetti, S., Blackall, L. L. and Majone, M. (1998). Some physiological properties of an Italian isolate of «Microthrix parvicella». En: Water Sci. & Technol.: Microorganisms in Activated Sludge and Biofilm Processes II. Ed. by The Conference Program Committee. (G.B.) BPC Wheatons. 37(4-5), 1 – 8.
Víctor Francisco Pacheco Salazar
Bertha Jáuregui Rodríguez
Thelma Beatriz Pavón Silva
Graciela Virginia Mejía Pedrero
OPS – CEPIS