Termodinámica de los Gases: 01- Orígenes de la Termodinámica. Parte 1
El ingeniero francés Sadi Carnot (1796-1832) es el fundador de la Termodinámica como disciplina teórica, escribió su trabajo cumbre a los 23 años. Este escrito estuvo desconocido durante 25 años hasta que el físico ingles William Thomson alias Lord Kelvin (1824-1907) redescubriera la importancia de las propuestas contenidas en él. Llamó la atención de Carnot el hecho de que no existieran teorías que avalaran las propuestas utilizadas en el diseño de las máquinas de vapor y que todo ello dependiera de procedimientos enteramente empíricos. Para resolver la cuestión propuso que se estudiara todo el procedimiento desde el punto de vista más general, sin hacer referencia a un motor, máquina o fluido en especial.
Posteriormente el físico alemán Rudolf Clausius (1822-1888) y Kelvin, fundadores de la Termodinámica Teórica, ubicaron el Principio de Carnot dentro de una rigurosa teoría científica estableciendo un nuevo concepto, el Segundo Principio de la Termodinámica. En esta época todavía tenía vigencia la Teoría del Calórico, no obstante ya estaba germinando la idea de que esa hipótesis no era la adecuada, en el marco de las sociedades científicas.
El físico inglés James Prescot Joule (1818-1889) se convenció rápidamente de que el trabajo y el calor eran diferentes manifestaciones de una misma cosa. Su experiencia mas recordada es aquella en que logra medir la equivalencia entre el trabajo mecánico y la cantidad de calor (concepto que veremos mas adelante no es correcto). Joule se valió para esta experiencia de un sistema de hélices que agitaban el agua por un movimiento producido por una serie de contrapesos que permitían medir la energía mecánica puesta en juego.
A partir de las investigaciones de Joule se comenzó a debilitar la teoría del calórico, en especial en base a los trabajos de Kelvin quien junto a Clausius terminaron de establecer las Bases Teóricas de la Termodinámica como disciplina independiente. En el año 1850 Clausius descubrió la existencia de la Entropía y enunció el Segundo Principio de la Termodinámica.
En 1851 Kelvin publicó un trabajo en el que compatibilizaba los estudios de Carnot, basados en el calórico, con las conclusiones de Joule, el calor es una forma de energía, compartió las investigaciones de Clausius, derrotaron juntos la Teoría del Calórico y reclamó para sí el postulado del Segundo Principio de la Termodinámica.
Hoy se ha llegado a un interesante perfeccionamiento de las máquinas térmicas, sobre una teoría basada en las investigaciones de Clausius, Kelvin y Carnot, cuyos principios están todavía en vigencia, la variedad de máquinas térmicas va desde las grandes calderas de las centrales nucleares hasta los motores cohete que impulsan los satélites artificiales, pasando por el motor endotérmico, las turbinas de gas, las turbinas de vapor y los motores de retropropulsión. Por otra parte la Termodinámica como ciencia actúa dentro de otras disciplinas como la química, la biología, etc.
Gracias a Clausius y Kelvin se convierte a la Termodinámica en una ciencia independiente de alto contenido teórico y matemático, lo que logra entender los fenómenos que se desarrollaban y fundamentar progresos tecnológicos.
1.1 CONCEPTOS FUNDAMENTALES
La Termodinámica es la ciencia que describe y relaciona las propiedades físicas de Sistemas Macroscópicos (conjunto de materia que se puede aislar espacialmente y que coexiste con un entorno infinito e imperturbable) de materia y energía. El estado de un sistema macroscópico en equilibrio puede describirse mediante variables termodinámicas o variables de estado, propiedades mensurables (que pueden ser medidas) como la Temperatura (T), la Presión (P) o el Volumen (V). Es posible identificar y relacionar entre sí muchas otras variables (como la densidad, el calor específico, la compresibilidad o el coeficiente de expansión térmica), con lo que se obtiene una descripción más completa de un sistema y de su relación con el entorno. Cuando un sistema macroscópico pasa de un estado de equilibrio a otro, se dice que tiene lugar una transformación o proceso termodinámico.
El Sistema Termodinámico más simple se compone de una masa fija de un fluido (un gas o un líquido) isotrópico puro (iguales propiedades en todas direcciones) no influenciado por reacciones químicas o campos externos. Tales sistemas se caracterizan por las tres variables de estado, a las que llamaremos PVT.
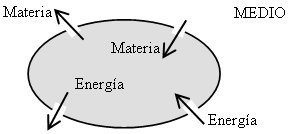
La Termodinámica denomina SISTEMA a la parte del Universo Termodinámico (U) cuyas modificaciones e interacciones con el resto del mismo nos interesa estudiar. Este puede ser cualquier objeto, cualquier cantidad de materia, cualquier región del espacio, etc. Se denomina MEDIO al resto del Universo Termodinámico que no pertenece al sistema. El sistema se encuentra separado del medio por medio de una envoltura imaginaria a la que denominaremos FRONTERA, la cual puede suponerse tiene propiedades especiales que sirven para:
1º) Aislar el sistema de su entorno o,
2º) Permitir la interacción de un modo específico entre el sistema y su medio.
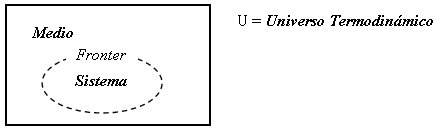 |
Si la frontera permite la interacción entre el sistema y el medio, tal interacción se realiza a través de los canales existentes en la frontera. Los canales pueden ser inespecíficos para interacciones fundamentales tales como el calor o la interacción mecánica o eléctrica, o muy específicos para interacciones de transporte.
Los sistemas termodinámicos pueden clasificarse en:
-
Sistema Aislado: es el sistema que no puede intercambiar materia ni energía con el medio.
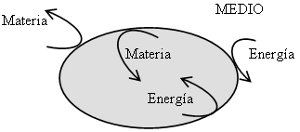
- Sistema Cerrado: es el sistema que sólo puede intercambiar energía con el medio, pero no materia.
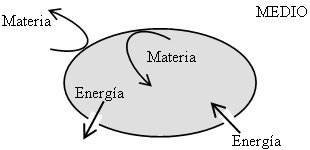
- Sistema Abierto: es el sistema que puede intercambiar materia y energía con el medio.
La Termodinámica solo se ocupa del estudio de las Propiedades Macroscópicas de un Sistema Termodinámico. Al conjunto de las propiedades termodinámicas lo denominaremos Estado de un Sistema. Cualquier sistema que muestre un conjunto de Variables de Estado (P, V, T) identificables tiene un estado termodinámico, ya sea que esté o no en equilibrio.
1.2 CONCEPTO DE TRANSFORMACIÓN
Diremos que un sistema termodinámico experimenta una Transformación si como mínimo, cambia de valor una variable de estado del sistema a lo largo del tiempo. Las transformaciones pueden clasificarse en tres tipos:
- Si el estado inicial es distinto del estado final, la transformación es Abierta.
- Si los estados inicial y final son iguales, la transformación es Cerrada.
- Si el estado final es muy próximo al estado inicial, la transformación es Infinitesimal.
Cualquier transformación puede realizarse por muy diversas maneras. El interés de la Termodinámica se centra en los estados inicial y final de las transformaciones, independientemente del camino seguido. Eso es posible gracias a las funciones de estado (Energía Interna, Entalpía, Entropía) que estudiaremos mas adelante.
1.3 EQUILIBRIO TERMODINÁMICO
Las propiedades termodinámicas de un sistema quedan definidas por los atributos físicos macroscópicos observables del sistema, mediante la observación directa o mediante algún instrumento de medida. Un sistema está en Equilibrio Termodinámico cuando no se observa ningún cambio en sus propiedades termodinámicas a lo largo del tiempo. Los estados de equilibrio son, por definición, estados independientes del tiempo.
Un estado de no equilibrio es un estado con intercambios de masa o energía o ambas y sus parámetros característicos dependen en general de la posición y del tiempo.
1.4 VARIABLES DE ESTADO
1.4.1 TEMPERATURA
Definimos como temperatura al estado térmico de la materia. Siendo el estado térmico el indicado por el nivel energético de las partículas (electrones, protones y neutrones) que forman al átomo de la sustancia en cuestión.
Para medir la temperatura de cualquier sustancia en sus diferentes estados de agregación (sólido, líquido o gaseoso), se emplea un termómetro. Dicho termómetro se encuentra graduado en una escala particular. Las escalas termométricas se pueden clasificar en relativas y absolutas:
- Escala Relativa: es una escala que necesita de una sustancia de la naturaleza para generar el patrón de comparación (agua) y además tiene valores negativos (Celsius y Fahrenheit).
- Escala Absoluta: es una escala que no necesita de una sustancia de la naturaleza para generar el patrón de comparación y no tiene valores negativos (Kelvin).
Es importante conocer los diferentes equivalentes de las escalas termométricas. Para hallar esta relación utilizaremos tres termómetros, cada uno en las escalas antes mencionadas que medirán dos estados particulares del agua, su punto de congelamiento y su punto de ebullición.
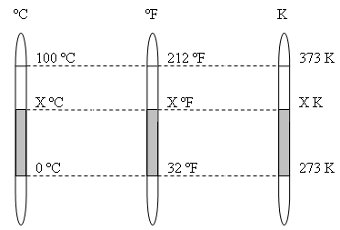 |
Suponiendo un mismo estado térmico X en todos los termómetros y aplicando la proporción entre los segmentos respectivos, tendremos:
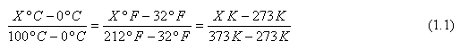 |
La cual simplificada nos da la relación buscada entre las escalas termométricas:
|
|
Si queremos pasar un valor de temperatura directamente de grados Celsius a grados Kelvin o viceversa, podemos aplicar las siguientes expresiones:
|
|
1.4.2 PRESIÓN
|
|
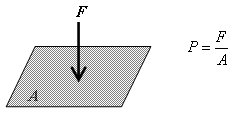
En física se define como presión (P) al cociente entre la fuerza (F) y la superficie o área (A) donde esta aplicada en forma perpendicular. Pero si consideramos a la masa de un gas dentro de un recipiente, la presión que el mismo ejerce, se puede clasificar en relativa y absoluta:
- Presión relativa: es la presión que un gas ejerce dentro del recipiente que lo contiene y puede leerse directamente del manómetro.
- Presión absoluta: es la suma de la presión relativa más la presión del medio que rodea al recipiente que contiene el gas. Si el medio es la atmósfera, habrá que sumarle una atmósfera o un bar.
En el Sistema Internacional de Medidas (SI) la presión se mide en Pascales, recordando que un Pascal (Pa) es equivalente a una fuerza de un Newton aplicada en una superficie de 1 m².
Existen diferentes escalas de presión derivadas de los diferentes sistemas de unidades. Si tenemos en cuenta las diferentes relaciones entre las escalas de presión podemos encontrar las siguientes equivalencias:
1 atm = 1 bar = 1,033 Kg / cm² = 1013 HPa = 760 mm Hg = 14,7 lb / plg² (1.5)
Para simplificar el pasaje de unidades de la presión adoptaremos una relación directa (ver Tabla de Unidades de Conversión):
1 atm = 1 bar = 1 Kg / cm² = 10.000 Kg / m²
1 atm = 1000 HPa = 100 KPa = 0,1 MPa
1 atm = 760 mm Hg = 14,7 lb / plg²
1.4.3 VOLUMEN
Esta definido por la capacidad del recipiente que contiene una determinada masa de gas o liquido (ver Tabla de Unidades de Conversión)
Fuente: www.escuelaraggio.edu.ar