Hidroarsenicismo crónico regional endémico en Argentina
Resumen
La contaminación natural del agua de consumo humano con Arsénico (As) en Argentina tiene más de 100 años de antigüedad y aún no ha sido solucionada.
Numerosos trabajos científicos ponen de manifiesto que el problema del As afecta en Argentina alrededor de cuatro millones de personas. El HACRE (hidroarsenicismo crónico regional endémico), patología provocada por la ingesta crónica de As en el agua y los alimentos, provoca afecciones de piel (leucodermia y/o queratosis), cáncer de piel, pulmón, vejiga, riñón, entre otros, alteraciones en el desarrollo, afecciones cardiovasculares, neurotoxicidad y diabetes. Dada la importancia del tema se señalan los avances en el conocimiento científico sobre el As en Argentina, especialmente en los últimos años. Se desarrollan diversos aspectos como los niveles actuales de As en aguas en el país y la contaminación de alimentos por la utilización de estas aguas. En población de Argentina, se evalúan biomarcadores de exposición, el perfil metabólico, biomarcadores y polimorfismos genéticos implicados en la susceptibilidad a la toxicidad del arsénico, biomarcadores de efecto, genotoxicidad, y evaluaciones del riesgo carcinógeno, relacionadas con la exposición al As. La evidencia recopilada en esta actualización no deja dudas sobre la gravedad del problema y del riesgo a la salud por la exposición crónica al As para una gran parte de los habitantes del país.
Palabras clave: arsénico * hidroarsenicismo crónico regional endémico * perfil metabólico * susceptibilidad * riesgo carcinógeno
Introducción
El conocimiento de la contaminación natural del agua de consumo humano con Arsénico (As) en Argentina lleva más de 100 años de antigüedad (1-4) y aún no ha sido solucionado. Existe suficiente evidencia científica que indica que gran parte del territorio argentino presenta agua con niveles de As perjudiciales para la salud (50 a más de 3000 μg/L) y son comparables a los niveles reportados en regiones asiáticas como Bangladesh, India. Por otra parte, restan muchas regiones que aún no han sido exploradas, siendo importante la incertidumbre existente sobre la real magnitud de la problemática del HACRE (hidroarsenicismo crónico regional endémico) en el país (5).
Numerosos trabajos se llevaron a cabo a partir de ese entonces y pusieron de manifiesto que el problema del As afecta en Argentina un área más grande de lo que inicialmente se pensaba.
En Argentina, alrededor de cuatro millones de personas están expuestas a altos niveles de As en el agua de bebida, en base al límite de 10 μg/L que establece la Organización Mundial de la Salud (6-8), siendo la más grande población de Latinoamérica expuesta (9).
Los efectos en la salud ocasionados por el As están bien documentados en Argentina ya desde principios del siglo XX. El caso más conocido de la patología provocada por la presencia del As en el agua de bebida y alimentos contaminados, es el de Belle Ville en Córdoba. El alto número de casos de HACRE en la ciudad de Belle Ville determinó que esta afectación se conociera como “enfermedad de Belle Ville” en 1913, año en que Goyenechea y Pusso la relacionaron con el consumo de agua con As (2) (10).
Es sabido del riesgo para la salud que presenta la exposición crónica al As provocando el hidroarsenicismo crónico regional endémico la cual es una patología frecuente en la Argentina (11) (12). El arsénico inorgánico (AsI) fue clasificado por la International Agency for Research on Cancer (IARC) (13) como un agente carcinogénico para humanos en base a estudios epidemiológicos que relacionan la ingestión de arsénico en el agua de bebida y el desarrollo de cáncer. En el año 2001, la población argentina expuesta se estima ba en aproximadamente un millón de personas (3% de la población del país) mientras que actualmente la población que habita en áreas con aguas arsenicales es de alrededor de cuatro millones de habitantes, más del 10% de la población del país (9).
Esta enfermedad, resultado de la exposición crónica al As presente en el agua de consumo, a concentraciones mayores de 10 μg/L y en los alimentos luego de un período variable de exposición, incluye afecciones en la piel como leucodermia y/o queratosis palmo-plantar, otras patologías más graves como diabetes, arteriopatías y aumento de la incidencia de cáncer de piel y de órganos internos (esófago, estómago, hígado, colon, pulmón, vejiga, próstata).
Se ha reportado (14) que las expresiones no carcinogénicas del arsenicismo pueden ser frecuentes y clínicamente identificables en poblaciones expuestas por aproximadamente 10 años mediante ingestión de agua con concentraciones de As de 100 μg/L.
Varios estudios han demostrado que en la población infantil expuesta durante el período prenatal y posnatal se afecta el desempeño neurológico (10) (15).
El problema se presenta en todos los lugares donde no hay plantas apropiadas de potabilización del agua de consumo domiciliario y en zonas rurales con población dispersa.
En el año 2000, el Sistema Nacional de Vigilancia Epidemiológica no tenía incluido el HACRE como problema de salud pública, y a la fecha no se ha implementado la notificación obligatoria de la patología a nivel nacional. Se estima que la máxima concentración tolerable de As en el agua es de 10 μg/L, valor recomendado por la Organización Mundial de la Salud (6-8). En el año 2007 el Código Alimentario Argentino (CAA) (16), en los Artículos 982 y 983 incorporó un valor guía de As en agua de 10 μg /L como nivel máximo a lograr en 5 años en las regiones endémicas pero llegado el año 2012 el CAA mediante la Resolución Conjunta 34/2012 y 50/2012 (17) prorrogó por cinco años la implementación del nuevo valor guía de As en agua (10 μg/L) para consumo humano, por falta de sustento científico que amerite la incorporación, “… hasta contar con los resultados del estudio –Hidroarsenicismo y Saneamiento Básico en la República Argentina – Estudios básicos para el establecimiento de criterios y prioridades sanitarias en cobertura y calidad de aguas…”. Esto significa que se permiten hasta 50 μg/L.
Las áreas arsenicales identificadas en el año 2006 sumaban alrededor de 435.000 km2 (10). Otros autores señalan que la llanura Chaco – Pampeana, en Argentina, es considerada como la región más extensa del mundo (1×106 km2), afectada por la presencia de As en aguas subterráneas (18-20).
En Santiago del Estero en el 43% de los departamentos (n=24) las aguas de bebida contienen As en niveles mayores a 50 μg/L. Esta investigación encontró que, dentro de la población estudiada, un alto porcentaje de personas está seriamente expuesta al As por el agua de bebida y los alimentos cocinados, hecho demostrado por las concentraciones de As en el agua, los alimentos, y la elevada excreción de As en orina (10) (21)(22).
Teniendo en cuenta la importancia del tema se desarrollarán los avances en el conocimiento científico sobre el problema del As en Argentina, especialmente en los últimos años, tratándose los siguientes tópicos: identificación de regiones argentinas con hidroarsenicismo (niveles de As en aguas), contaminación de los alimentos debido a la utilización de aguas arsenicales, estudios sobre biomarcadores de exposición y efecto (genotípico, y sobre la reproducción y salud infantil), variaciones genéticas que afectan la susceptibilidad a enfermar, evaluaciones de riesgo, perfil metabólico y riesgo de aparición de cáncer y de otras patologías.
Regiones argentinas con hidroarsenicismo y concentraciones de As en aguas
Son numerosos los datos de As en aguas de consumo humano en diversas provincias y regiones del país. Muchos trabajos se refieren a aguas subterráneas o acuíferos, o superficiales sin aclarar el uso de dichas fuentes. Debe considerarse que en muchas regiones las aguas subterráneas, y a veces las superficiales, son la única fuente tanto para uso animal como para consumo humano.
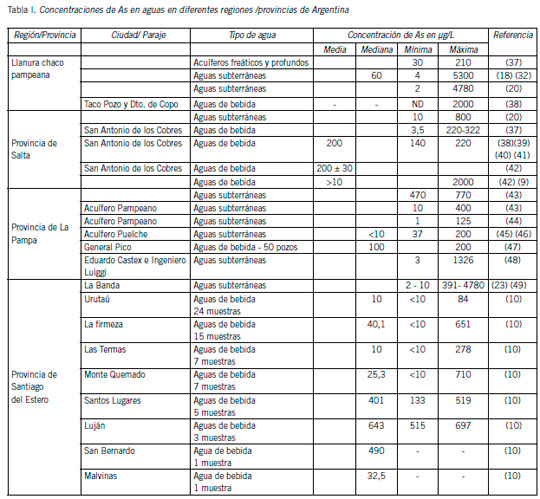
Se han detectado altas concentraciones de As en aguas en la llanura Chaco-Pampeana, en la región andina de Cuyo, en la región central y en el noroeste del país. Concentraciones de As en agua de bebida de hasta 1000 μg/L se han identificado en una alta proporción de aguas provenientes de pozos subterráneos. Córdoba, Santiago del Estero y Chaco son las provincias con las más altas concentraciones de As (9)(23-31).
La zona más afectada de Argentina, es sin duda la región Chaco-Pampeana donde al menos el 20% de los habitantes tienen además necesidades básicas insatisfechas. En general, la pobreza es mucho mayor en las llanuras de la región del Chaco, en comparación con la llanura Pampeana. Alrededor del 17% de la población total vive en comunidades rurales con menos de 2.000 habitantes, mientras que casi el 12% vive en asentamientos dispersos, con menos de 50 habitantes (23-27). Los acuíferos poco profundos con altas concentraciones de As son el único recurso disponible de agua potable durante todo el año para la mayoría de la población rural.
El As en la llanura Chaco-Pampeana en el centro de Argentina cubre una superficie de unos 10 millones de km2. Las provincias más afectadas de la región incluyen Santiago del Estero, Chaco, Salta, Tucumán, Córdoba, Santa Fe y La Pampa (32). Esta gran región es una de las más densamente pobladas de Argentina, siendo la calidad del agua subterránea para el consumo humano baja, debido a las elevadas concentraciones de As (28)(33-34).
Ya en la década del 80 Nicolli et al. (28) señalaron que el 82% de las muestras de agua analizadas en la región Chaco-Pampeana excedían los 10 μg/L que recomienda la Organización Mundial de la Salud (WHO).
Córdoba, Santiago del Estero y Chaco son las provincias con las más altas concentraciones de As (9) (10) (23-31).
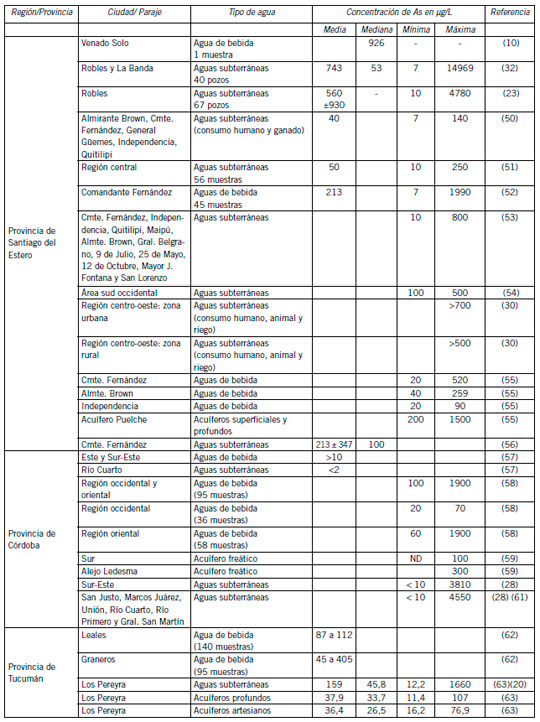
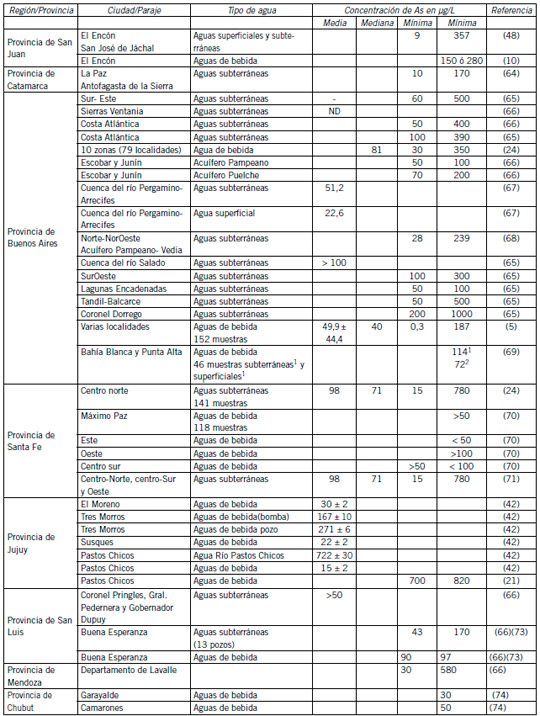
En la Tabla I se muestran datos reportados de concentraciones de As en aguas argentinas y el tipo de agua.
REGIÓN DE LA PUNA
Se han detectado altas concentraciones de As en aguas (1500 μg/L) en el noroeste del país con una alta proporción de aguas provenientes de pozos subterráneos (54).
Según se observa en la Tabla I, se halló As en aguas de bebida, en una región andina cercana a Chile, en concentraciones elevadas, señalando los autores (9)(41) exposiciones al As a través de diferentes fuentes de agua potable y un aumento de su concentración en el tiempo. El 61% de los 46 pozos analizados contienen más de 10μg/L y una concentración máxima de 2000 μg/L.
Concha et al. (37) señalan niveles de As en agua de red (200 μg/L), en San Antonio de los Cobres y en agua de manantial, ambas aguas utilizadas para beber.
 |
 |
 |
En Jujuy se detectaron niveles de As en agua para consumo humano de 800 μg/L (21) y otras de hasta 2000 μg/L (74).
REGIÓN CHAQUEÑA
Datos de monitoreo de las aguas subterráneas, realizados por el gobierno provincial de Santiago del Estero en 1984, indicaban gran variabilidad espacial en la concentración de As en el agua. En extendidas zonas, las concentraciones exceden los 400 μg/L, superando de 8 a 40 veces los límites permisibles de As en agua potable en Argentina de 50 μg/L (16)(17), o el valor de referencia de la WHO de 10 μg/L respectivamente (6-8). En La Banda, Santiago del Estero, durante 1998 se analizaron 65 muestras de agua y durante 1999 otras 27 hallándose concentraciones de As en un rango de 2 a 391 mg/L en 1998, y durante 1999 desde 10 a 4780 μg/L (23)(48).
Otros estudios realizados en la región central oeste de la Provincia del Chaco (31) informan en muestras de aguas subterráneas de diferente profundidad, que el 88% de las muestras exceden los límites recomendados por la WHO de 10 μg/L. En ciertas regiones de esta provincia se han reportado valores máximos de 800 μg/L (52) y en la ciudad de Taco Pozo 200 μg/L de As en el agua de bebida (5)(38)(39) situación conocida desde hace mucho tiempo y aún no resuelta. Las concentraciones máximas de As mencionadas en aguas subterráneas de Roque Sáenz Peña (700 μg/L), son superiores a las del área pampeana sudoccidental (100-500 μg/L) (49)(53). En la región central de la provincia del Chaco se hallaron concentraciones de As en aguas de pozos superando el valor guía de 10 μg/L en el 91% de las 45 muestras analizadas y el 73% supera el valor límite del CAA (50 μg/L) (51).
En Taco Pozo, en el Departamento de Copo y en el Departamento de Robles en la provincia de Santiago del Estero, se hallaron en concentraciones mayores a 2000 μg/L (5)(24)(38).
En la región oriental de la provincia de Tucumán se han reportado concentraciones máximas de 1660 μg/L (62).
REGIÓN DE CUYO
Las provincias de San Luis, San Juan y Mendoza no escapan a la contaminación de las aguas de bebida con As, habiéndose informado niveles de 170 μg/L en la localidad de Buena Esperanza, provincia de San Luis (72), 280 μg/L en El Encón, provincia de San Juan (10), y hasta 580 μg/L en el departamento de Lavalle en Mendoza (65).
En la Provincia de San Juan se informaron concentraciones de As en aguas hasta 357 μg/L (47).
REGIÓN PAMPEANA
En la provincia de Córdoba se reporta que el 89,8% de la provincia se encuentra afectada por las elevadas concentraciones de As en agua subterránea, con valores mayores a 10 μg/L y que las regiones este y sureste de la provincia de Córdoba poseen concentraciones altas de As en el agua subterránea, muy por encima de los límites permitidos por las normativas, con una muy alta variabilidad espacial (horizontal y vertical) (56). En la región sudoriental de la Provincia de Córdoba, un 46% de las muestras contienen As entre 100 y 316 μg/L (28), y en otros departamentos de la provincia como San Justo, Marcos Juárez, Unión, Río Cuarto, Río Primero y General San Martín, el As en el agua subterránea se halló entre < 10 y 4550 μg/L (28) (57)(59)(60).
Paolini et al. (64) reportan que en la llanura pampeana, más de la mitad de las muestras de agua tienen concentraciones de As superiores a 50 μg/L. En la provincia de La Pampa se identificaron un número sumamente grande de fuentes de agua con alto nivel de As en zonas rurales (18).
En la provincia de Santa Fe se han caracterizado 3 áreas de acuerdo al contenido de As en sus acuíferos: una franja este, próxima al río Paraná, con valores inferiores a 50 μg/L; una franja oeste con valores superiores a 100 μg/L y una franja centro-sur con niveles intermedios de As. En Máximo Paz de un total de 118 mediciones, 29 exceden los 50 μg/L, indicando que el 25% de la población está expuesta a concentraciones de As en el agua de bebida por encima del límite del CAA (69). Los departamentos donde se han registrado niveles de As superiores a 50 μg/L fueron Belgrano, Castellanos, General López, Iriondo, Las Colonias, 9 de Julio, San Cristóbal, San Jerónimo, San Martín y Vera. En las regiones centro-norte, centro sur y oeste de la provincia de Santa Fe, sobre 41 muestras de agua analizadas se hallaron valores de As de hasta 780 μg/L (70). Considerando la totalidad de la provincia de Santa Fe en 1999, según datos de Vázquez et al. el 37% de los habitantes consumen aguas con niveles de As superiores a 50 μg/L en un rango de > 50 a >200 μg/L (75).
En la provincia de Buenos Aires, en las sierras del Sistema de Ventania, las aguas están desprovistas de As desde las sierras hasta las áreas de circulación, pero en la región de la costa se han registrado concentraciones de hasta 400 μg/L (70). En la cuenca del río Pergamino- Arrecifes el 40% de las muestras analizadas contienen As en una concentración promedio mayor al límite fijado por el CCA para aguas de consumo humano (66), y presentan niveles de hasta 239 μg/L en la localidad de Vedia (67), mientras que en la cuenca del río Salado, la concentración de As en aguas subterráneas supera los 100 μg/L. Al suroeste de la provincia se informaron concentraciones de As entre 100 y 300 μg/L con máximas concentraciones en la costa atlántica (100-390 μg/L). En el centro sur de la provincia (Tandil-Balcarce) el As llega hasta 500 μg/L y en Coronel Dorrego hasta 1000 μg/L (64). En 152 muestras de aguas de bebida (agua de red) de varias localidades de la provincia de Buenos Aires, se encontró As en un rango desde 0,3 a 187 μg/L, con una mediana de 40 μg/L. El 82% de las muestras presentaron niveles de As superiores al valor límite aceptable de 10 μg/L (76). En Bahía Blanca y Punta Alta se avaluó el agua que abastece a una población de aproximadamente 400.000 habitantes de un área de alrededor de 400 km2.
Las aguas provienen de fuentes subterráneas y superficiales y se estudiaron 46 puntos encontrándose que superan los niveles guías para As el 97,3% de las muestras subterráneas y el 100% de las muestras en aguas superficiales (68).
En la Pampa, en localidades como General Pico, se reportaron resultados de As en 50 pozos (1370 muestras de agua subterránea) que abastecen a la localidad, en niveles de hasta 200 μg/ L (46).
REGIÓN PATAGÓNICA
En la provincia de Chubut se monitoreó la concentración de As en agua de consumo humano en la red pública de 27 localidades. En 25 localidades, el As estuvo por debajo de 20 μg/L, mientras que en las localidades Garayalde y Camarones se alcanzaron concentraciones de 30 y 50 μg/L, respectivamente (73).
REGIÓN ANTÁRTICA
En la Antártida altos niveles de As (35 ± 32 μg/g) se detectaron en varias especies de algas obtenidas de la Caleta Potter, en la Isla King George de las Islas South Shetland, llegando en algunos casos a hallarse en concentraciones 20 veces mayores que en otras especies. Los autores lo atribuyen a las características geológicas de la región lo cual indica contaminación de las aguas de la región (77). Otro estudio realizado sobre nueve especies de macro algas recolectadas en la Estación Jubany, cercana a Caleta Potter en la Antártida, tienen la capacidad de acumular As a partir del agua oceánica, siendo la especie Phaeurus antarcticus la que mostró la mayor capacidad de bioconcentración (78). Estos resultados están indicando que la contaminación natural por As llega hasta la Antártida.
ARSÉNICO EN AGUAS DE BEBIDA EN VARIAS PROVINCIAS ARGENTINAS
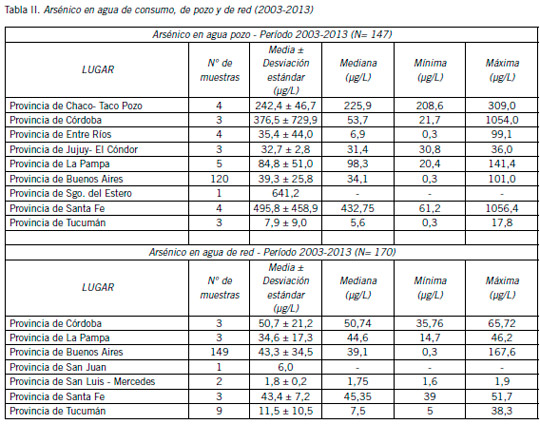
Durante los años 2003-2013 fueron investigados los niveles de As en muestras de aguas de pozo y agua de red, utilizadas para consumo humano, procedentes de diversos lugares del país. La cuantificación de As se realizó por absorción atómica-generación de hidruros de acuerdo al método de Navoni et al. (79). De agua de pozo se analizaron 147 muestras y de red 170 procedentes de diversos puntos del país. Los resultados generales se muestran en la Tabla II (datos propios no publicados). Las concentraciones medias en aguas de pozo estuvieron comprendidas entre 7,9 μg/L en Tucumán y 495,8 μg/L en Santa Fe, mientras que en aguas de red entre 6 μg/L en San Juan y 50,7 μg/L en Córdoba.
 |
Geoquímica de suelos y sedimentos
La presencia natural del As en suelos argentinos es de origen volcánico, abarca una extensa zona rica de terrenos arseníferos de la región central y norte del territorio argentino y produce contaminación de las napas de agua (80-83). Es numerosa la bibliografía que hace referencia a los elevados niveles de As encontrados en las aguas en Argentina, asignándosele principalmente un origen geológico (9)(18) (29)(30)(35)(51) (59) (60) (74)(84-88)(90).
Además de haberse determinado la concentración de As en aguas subterráneas, se han realizado estudios sobre la geoquímica de los suelos y sedimentos (23)(26) (28) (32)(33-34)(84)(91) y ha resultado que el As en las aguas subterráneas de Argentina proviene de los sedimentos del Cenozoico, constituyentes de los principales acuíferos (33) y por fragmentos de vidrio volcánico en los sedimentos (32), y se moviliza bajo condiciones hidrogeoquímicas de alto pH en condiciones aeróbicas. Los autores señalan que la llanura Chaco-Pampeana estudiada presenta un mecanismo de movilización del As muy diferente al observado en las aguas subterráneas de los acuíferos del sureste de Asia, específicamente respecto a la cuenca de Bengala (33).
CONTAMINACIÓN POR ARSÉNICO, DE LOS ALIMENTOS NO PREPARADOS Y COCINADOS Y BIOACCESIBILIDAD
Se han evaluado dos aspectos referentes al As presente en los alimentos, uno cuantificando el As, total e inorgánico, en el alimento no preparado o cocido y el otro en los alimentos ya cocinados y listos para su ingesta. Además se han llevado a cabo evaluaciones de las ingestas diarias del As en población expuesta y existen estudios sobre la bioaccesibilidad del As presente en los alimentos cocinados.
CONTENIDO DE AS (TOTAL E INORGÁNICO) EN ALIMENTOS NO PREPARADOS
En estudios realizados en leche de vaca (87)(92), en los cuales estimaron los factores de biotransferencia (BTF,) se encontraron valores de 1,5 x 10-5 y 4,3 x 10-4 día /litro en Córdoba y cercana a cero en Santa Fe indicando una baja transferencia del As a la leche vacuna. Los niveles de As en las leches procedentes de Córdoba estuvieron entre 0,5 y 7,8 μg/L en zonas de agua de pozos poco profundos con una concentración media elevada de As de 1550±957 μg/L y entre 0,5 y 2,5 μg/L en leches de regiones con aguas de pozo profundos con concentraciones bajas de As, 64±23 μg/L (87).
En otro estudio se midió As en tejidos, riñones, hígado, músculo y ubre, y en leche bovina en la provincia de Córdoba (88). El agua utilizada por el ganado presentaba una concentración entre 230 y 2540 μg/L, y se halló en leche, desde 2,8 a 11 μg/L (media 3,5±2 μg/L), en hígado, 27 a 47 μg/kg (media 38±9 μg/kg), en riñón, 24 a 73 μg/kg (media 44±17 μg/kg) y en músculo por debajo del límite de detección (0,1 μg/ kg). Estos resultados indican que la leche proveniente de ganado de regiones de HACRE, no contiene elevados niveles de As, por lo cual la ingesta de leche fluída fresca no es una importante vía de exposición alimentaria al As.
Otros alimentos en los cuales se halló As, fue en músculo e hígado de llama, alimentos de consumo habitual en el norte argentino (Jujuy) (89) siendo la concentración del As en el agua de la región superior a 200 μg/L (25)(41)(84). En músculo la concentración media encontrada expresada en μg/kg ph (peso húmedo) fue de 132 en áreas de relativamente baja concentración de As en el agua (en Abra Pampa), y en áreas con altas concentraciones en el agua como Rinconadillas se halló 114 y en el Moreno 233±41 (27).
Otro alimento que contribuye a la ingesta de As es el arroz. Se analizaron 32 muestras de arroz adquiridas en Buenos Aires hallándose una concentración mediana de As total (AsT) de 0,296 μg/g ps (peso seco) y de As inorgánico (AsI) de 0,104 μg/g ps. En las tres provincias argentinas productoras de arroz, se han detectado elevadas concentraciones de AsT: Entre Ríos 0,480; Misiones 0,451 y Corrientes 0,690 μg/g ps (93) (94).
CONTENIDO DE AS (TOTAL E INORGÁNICO) EN ALIMENTOS COCINADOS Y EVALUACIÓN DE LA INGESTA DIARIA
Es sabido que la presencia de As en los alimentos (cultivos, productos de la pesca, carne de ganado, y otros) está asociada a la presencia de altas cantidades de este elemento en los suelos y en las aguas de riego pero también se han desarrollado estudios que muestran que el As puede ser transferido desde el agua con la cual se preparan los alimentos a las comidas preparadas, magnificando así el contenido de As en la dieta humana (9)(10)(95-97). Además, la especie de As puede cambiar durante la preparación de alimentos, especialmente durante la cocción a alta temperatura, cuando se utilizan procedimientos como asar y freír, modificando la toxicidad del As (27).
Vahter et al. (99) señalan que de los alimentos preparados de San Antonio de los Cobres en Salta, (As en agua de bebida 200 μg/L), el de mayor contenido de As fueron las sopas, 340 μg/kg (rango 260–430 μg/kg) mientras que en empanadas se hallaron 130 μg/kg, y en polenta 58 μg/kg. Esto corresponde a una ingesta diaria (TDI) de As de 270-370 μg, valores muy elevados y de riesgo toxicológico teniendo en cuenta el valor guía de la ingesta diaria tolerable provisional (ISTP) sugeridos por la Food and Agriculture Organization of the United Nations/World Health Organization (FAO/WHO) de 2,1 μg/kg peso corporal/día (99).
La evaluación del contenido de As en alimentos preparados del Departamento de Copo, Santiago del Estero, se realizó en dos áreas, una de baja exposición (As en agua <10 μg/L) encontrándose un rango de concentraciones de AsI entre10-40 μg/g ph siendo éste entre 67-100% del As total y en otra área de alta exposición (As en agua entre 400 y 700 μg/L) hallándose entre 520-1330 μg/g ph de AsI, correspondiendo a 94 y 100% del As total. La Ingesta diaria estimada (TDI) en la zona de alta exposición resultó ser, considerando la población adulta, el consumo de agua y alimentos de 150 μg/día y en caso de los niños, 53 μg/día (5)(97), valores ampliamente superados de la ISTP en la región de alta exposición. Actualmente la FAO/WHO considera que el valor de 2,1 μg/kg/día, no es apropiado ya que está en la región del Límite inferior de confianza dosis de referencia BMDL0,5 (99) siendo el BMDL0,5 la dosis experimental que se asocia a un 0,5% de incidencia o riesgo extra a desarrollar cáncer según indica la Agencia Catalana de Seguridad Alimentaria (ACSA)(100). La dosis BMDL0,5 propuesta por la European Food Safety Authority (EFSA)es de 2-7 μg As inorgánico/kg peso corporal/día (101). En las localidades de la zona estudiada con niveles de As en aguas de bebida dentro de los límites aceptables, el aporte de As a la TDI fue muy pequeño, siendo en las zonas de HACRE, superada varias veces, 6 en el caso de adultos de 70 kg y 13 veces cuando se trata de niños de 25 kg. (9)(96)(97). La alta exposición a AsI presente en al agua y los alimentos cocinados, es indicadora de un grave problema de salud de las poblaciones rurales dispersas en el departamento de Copo (región chaqueña). Los autores señalan que es necesario tomar medidas urgentes para la provisión de agua segura para las poblaciones afectadas, a fin de proteger la salud y el futuro de estos pobladores y especialmente de los niños (9)(96)(97).
Otros estudios de regiones endémicas de Argentina indican que los alimentos preparados con aguas contaminadas con As contribuyen con más del 50% de la ingesta total de As, y que la preparación de alimentos con estas aguas aumenta de forma importante su contenido en As (5).
En la región de Taco Pozo, Chaco con As en el agua de 220 μg/L, se evaluó el contenido de As en alimentos cocinados. El As inorgánico (78- 690 μg/g ph) representó más del 57% del As total, indicando el importante efecto de la preparación y cocinado de los alimentos con agua de elevados contenidos en As (95). En guiso cocinado con aguas con 220 μg/L de As, se encontraron 751 μg/kg ps de AsT y 690 μg/kg ps de AsI. La contribución a la dosis de exposición al AsI, para distintos grupos de edades, se situó en adultos entre 0,23 a 0,34 μg/kg pc (peso corporal)/día, en adolescentes entre 0,29 a 0,43 μg/kg pc/día y en niños entre 490 a 740 μg/kg pc/día, para una porción de alimento de 350 g en adultos y adolescentes y 200 g para niños. La exposición en niños fue superior a la de adolescentes y adultos, superando entre 1,5 a 2,6 veces el límite máximo recomendado por FAO/WHO (99) debido a que presentan una mayor relación ingesta/ peso corporal (102).
ESTUDIOS SOBRE BIOACCESIBILIDAD DEL ARSÉNICO INORGÁNICO
Con el objeto de evaluar su bioaccesibilidad, ocho muestras de arroz fueron sometidas a una digestión gastrointestinal in vitro. Las concentraciones de AsT de la fracción soluble de los arroces crudos variaron entre 0,190 y 0,442 μg/gps (media: 0,309 ± 0,085 μg/g ps). Un alto porcentaje del As total (64%-98%) se solubilizaría tras la digestión gastrointestinal y se encontraría disponible para ser absorbido por el epitelio intestinal. Las concentraciones de AsI oscilaron entre 0,055y 0,122 μg/ gps (media: 0,080 ± 0,023 μg/ gps), siendo bioaccesible entre el 70% y el 90% del AsI. La única especie inorgánica presente fue el As(+V), siendo el ácido dimetilarsínico (DMA) la especie mayoritaria cuyas concentraciones oscilaron entre 0,157 y 0,320 μg/g ps (93)(94).
La bioaccesibilidad del As de los alimentos preparados de la región de Taco Pozo fue superior al 50%, por lo que una elevada cantidad de As queda disponible para su absorción intestinal, con lo cual es importante que éstos se consideren al momento de efectuar evaluaciones de la exposición de poblaciones de zonas de HACRE (5) (96). En Pastos Chicos (As en el agua 700 a 800 μg /L) el AsT en alimentos se halló entre 20 y 1920 μg /kg ph, correspondiendo al AsI entre el 82 y el 115%. La fracción bioaccesible de AsI fue del 63 ± 9% del AsT en los alimentos sólidos. La ingesta diaria estimada (TDI) de AsI considerando la ingesta de agua y alimentos excede la ISTP 15 veces (21).
Los estudios descritos proporcionan evidencia científica que apoya la necesidad de una intervención rápida, al igual que en el caso de algunas zonas endémicas de As en Asia, para reducir la exposición de las poblaciones afectadas tanto adultas como infantiles. Con el objeto de reducir el riesgo de la exposición al As y evaluar en forma precisa dicha exposición, es necesario prestar más atención a la contaminación por As de los alimentos (5)(9)(21) (95-97) (102).
Biomarcadores de exposición
Los biomarcadores utilizados para la evaluación de la exposición al As, por todas las fuentes, son su concentración en la orina, el cabello y las uñas (103)(104), siendo el biomarcador más usado el As total urinario de acuerdo a lo que señala el Comité Mixto de Expertos en Aditivos Alimentarios (FAO /OMSJECFA)(105).
En Argentina se han evaluado los niveles de As en muestras de pelo de individuos de zonas de HACRE los cuales presentaron un valor medio de 4,2 μg As/g (rango: 0,4 a 20,0 μg/g) comparadas con muestras de población no-expuesta, con niveles de As desde 0,09 a 0,28 μg/g (82). Un reciente trabajo realizado en cabello analizó 20 muestras provenientes de Almirante Brown, Chaco, con As en aguas de bebida entre 50-900 μg/L. Se determinaron diferentes especies del As por micro-Fluorescencia de Rayos-X, radiación de Sincrotrón (SR-μXRF) y energía alrededor del borde Kα del As (XANES), encontrándose las especies As(+III), As(+V) y DMA(+V). Las concentraciones de As Total en μg/g correspondientes a medias, mediana, mínima y máxima fueron 8,4; 5,8; 0,1 y 30,2 respectivamente (106) indicando alta exposición.
Evaluando población de la provincia de Salta, en San Antonio de los Cobres con contenidos de As en aguas de 200 μg/L, Vather et al. (98), encontraron niveles medios de AsI urinario entre 14 y 256 μg/L y de As total entre 18 y 258 μg/L, concluyendo los autores que el AsI fue la principal especie arsenical ingerida por la población. Varios estudios epidemiológicos se valieron del As urinario como marcador de la exposición a este elemento (5)(76)(82)(107). Por exposición crónica el As urinario (AsU) llega a un valor estacionario el cual se correlaciona con la concentración de As en el agua de bebida. Asociado a esto, la facilidad de recolección de una muestra no invasiva hace que el AsU resulte conveniente como marcador de exposición. En Argentina en la región chaqueña, se llegaron a encontrar orinas humanas con un contenido de As de casi 4000 μg/g creatinina (5)(76) (107)(108).
Las concentraciones de As en las aguas de bebida se correlacionaron con los niveles de excreción del AsI urinarios de una población de un área de baja exposición 11-335 μg/g creatinina, y de otra con alta exposición 68- 3918 μg/g creatinina (coeficiente de correlación r= 0,86; n = 65; 99% confianza) (96).
Se evaluaron 650 personas de 19 localidades de las provincias de Santiago del Estero y Chaco expuestas a As en las aguas de bebida (192 muestras; As entre 1,7 a 2055 μg/L). Más del 80% de la población estuvo expuesta al As, evaluada mediante el AsU (> 5000 μg/g creat), superando el nivel de la reportada en Latinoamérica y siendo comparable a la descripta en otras regiones endémicas de hidroarsenicismo en el mundo (108).
Variabilidad del perfil metabólico del arsénico urinario, polimorfismos y susceptibilidad
Perfil metabólico del arsénico urinario y polimorfismos enzimáticos
PERFIL METABÓLICO DEL ARSÉNICO URINARIO
Los metabolitos urinarios del As, el As inorgánico (AsI) (As+III y As+V), el ácido metilarsónico (MMA) y el ácido dimetilarsínico (DMA), y sus proporciones están relacionadas con los efectos adversos para la salud por la exposición crónica al As. Estos porcentajes de eliminación presentan variaciones en la población humana expuesta y hay evidencias de que varios factores lo afectan. El perfil de excreción urinarios de los metabolitos (%AsI, %MMA y %DMA) presenta variaciones genéticas de acuerdo a los patrones de metilación dentro de familias, donde sólo el 30% de las diferencias metabólicas (medida por la relación MMA:DMA) puede explicarse por factores como el nivel de exposición, el tabaquismo, el sexo, el polimorfismo genético, la etnia y otros (37) (109-115).
POLIMORFISMOS ENZIMÁTICOS Y SUSCEPTIBILIDAD
Los resultados encontrados sobre polimorfismo en pobladores de San Antonio de los Cobres (expuestos a aguas con As aprox. 200 μg/L), indican que el polimorfismo de la 3 metilarsénico-transferasa AS3MT, y posiblemente de la glutatión-S-transferasa-M1 (GSTM1), glutatión-S-transferasa-T1 (GSTT1), metiltetrahidrofolato homocisteína metil-transferasa (MTR) y metilentetrahidrofolato- reductasa (MTHFR), serían responsables en gran parte de las variaciones interindividuales observadas en el metabolismo del As, en el perfil de excresión y en la variabilidad de la susceptibilidad que presenta la población de zonas de hidroarsenicismo (112).
El mismo grupo de investigadores ya habían encontrado que la eficiencia de la metilación del As, en la misma población estudiada, es estable en el tiempo y no encontraron diferencias en los niveles de excreción de los metabolitos en un mismo individuo dentro del mismo día (116).
El perfil de metilación del As urinario y el polimorfismo genético de la metilentetrahidrofolato-reductasa (MTHFR) y glutatión-S-transferasa (GST) fue investigada en 10 sujetos de San Antonio de los Cobres, zona de HACRE en Salta. Se encontró que la población con la variante alélica TT/AA de la MTHFR 677/1298 excreta una proporción significativa más alta del AsI y una menor proporción de DMA. Las mujeres con el genotipo nulo de la GSTM1 eliminan una proporción significativa mayor de MMA (de mayor riego toxicológico) que las que poseen el genotipo activo. Los autores no encontraron asociación entre el polimorfismo de la GSTT1 y la metilación del As pero sí encontraron evidencia que indica que la MTHFR y la GSTM1 están involucradas en el metabolismo del As en humanos y que el polimorfismo en los genes que codifican estas enzimas puede jugar un importante rol en la susceptibilidad para la toxicidad del As (113) (114). Los autores señalan que en la población estudiada, los portadores del genotipo activo GSTM1 (glutation S-transferasa) presentan una disminución del % MMA urinario mientras que en los que presentan el genotipo nulo, se observa un incremento significativo del % MMA y disminución del % DMA equivalente a un aumento de la susceptibilidad a que se desarrolle la patología propia del As. Respecto al polimorfismo de la GSTT1, Steinmaus et al. (113) (114) estiman que no parece estar asociado con las variaciones de los porcentajes de los productos metabólicos del As (perfil metabólico).
Otro polimorfismo que afecta el perfil de excreción urinaria de los metabolitos del As es el de la enzima metilenetetrahidrofolato reductasa (MTHFR), cuya variante alélica MTHFR 222Val se ha asociado con baja actividad enzimática y altos niveles de homocisteína plasmáticos lo cual disminuye la relación DMA/MMA con el consiguiente aumento de la susceptibilidad de enfermar (112) (114). Resultados similares en la población expuesta estudiada antes mencionada se observaron respecto a la metil-transferasa (MTR) y en menor grado con la colina dehidrogenasa (CHDH) y la metiltransferasa reductasa (MTRR) (112) (117).
Metabolitos de As en orina fueron evaluados en 45 casos de cáncer de pulmón de zonas de Córdoba expuestos al As y 75 controles no expuestos (118). La media del % de MMA fue mayor en los casos que en los controles (17,5% frente a 14,3%, p=0,01). Estos resultados indican que los riesgos de cáncer de pulmón podrían ser más altos en aquellos con un alto % de MMA urinario y que también son portadores de las variantes alélicas rs234709 y rs4920037 de la cistationina-beta-sintasa (CBS). Este estudio es el primero en reportar una asociación entre las diferencias individuales en el metabolismo del As y el cáncer de pulmón, la principal causa de mortalidad relacionada con el As. Estos resultados se suman a la creciente evidencia de que la variación en el metabolismo del As juega un papel importante en la susceptibilidad de enfermar por la exposición al As (118).
POLIMORFISMOS DE LA AS (+III)
METILTRANSFERASA (AS3MT)
El genotipo de la AS3MT es probablemente un factor que predispone a una mayor susceptibilidad para la toxicidad del As, por lo cual la distribución alélica de los polimorfismos de la AS3MT debería ser tomado en cuenta en las evaluaciones de riesgo. Los polimorfismos de la AS3MT predicen significativamente el metabolismo del As, lo que sugiere que una alteración polimórfica de la AS3MT afectará el perfil metabólico del As y puede estar presente en cualquier población del mundo. Los polimorfismos de la AS3MT ligados a la eficiencia de la metilación se asociaron con una menor expresión del gen AS3MT. La evaluación de los polimorfismos es de importancia para la evaluación de riesgos de la exposición al As, debido a que una baja eficiencia de la metilación se relaciona con un mayor riesgo de cáncer (119) (120).
Se ha demostrado que las variaciones en el gen de la As3MT son las que más influencian el balance de metabolitos urinarios. Engström et al. (112) han identificado en una población de San Antonio de los Cobres, variantes alélicas asociadas con bajos porcentajes de MMA y altos de DMA que conducen a una relación más alta para la segunda etapa de metilación (conversión de MMA en DMA), lo cual disminuye el riesgo del desarrollo del cáncer típico de este elemento.
Esta situación no es igual para toda la población expuesta crónicamente al As en Argentina, ya que estudiando otras regiones del norte argentino (Taco Pozo) con concentraciones de As en aguas de bebida similares, y donde se han estudiado las mismas variantes alélicas en el gen de la As3MT, se han observado excreciones de MMA muy elevadas y bajas concentraciones de DMA (5).
Es posible que en ciertas comunidades se hayan desarrollado mecanismos de protección mediante variantes polimórficas, u otras, resultado de una adaptación a las adversas condiciones ambientales, mientras que en otras, con probablemente mayor movilidad poblacional, no permanezcan el tiempo suficiente como para que esto ocurra o que participen otros factores no investigados. Otro reporte en el cual se estudiaron 202 mujeres del norte argentino, expuestas y no expuestas al As en el agua de bebida (3,5−200 μg/L) indica que se halló que el As urinario (suma de los metabolitos) estaba positivamente asociado a la longitud relativa del telómero en sangre y que los habitantes con fracciones medias de AsI y MMA más altas, mostraron un aumento significativo de la longitud del telómero con el aumento del As urinario, respecto a las que presentaban una media más baja. Los hallazgos de este estudio sugieren que parte de la carcinogenicidad del As puede ser a través de la ampliación lapso de vida de las células premalignas por
el alargamiento de los telómeros. Los autores (121) señalan además, que las portadoras del haplotipo AS3MT que metabolizan al As en forma más lenta (metabolismo más tóxico), mostraron asociaciones positivas más fuertes entre la exposición al As y la longitud de los telómeros, en comparación con los no portadores (interacción arsénico urinario y haplotipo p=0,025) y concluyen que el As en el agua potable influye en la longitud de los telómeros, ya que un metabolismo más rápido (genera menor toxicidad) y disminuye la elongación del telómero relacionado con el As. Esto puede ser un mecanismo para el desarrollo carcinogénico del As (121).
POLIMORFISMOS DE LA AS (+III)
METILTRANSFERASA (AS3MT), GENOTIPO Y ETNIA
La influencia del nivel de exposición al As sobre el metabolismo humano se estudió en residentes del Chaco y Santiago del Estero. El amplio rango de valores de AsUde 18 a 4103 μg /g de creatinina) se correlacionó positivamente (Rs = 0,38, p <0,0001) con el % de MMA urinario, y negativamente (Rs = -0,32, p<0,001) con el porcentaje de DMA urinario. Cuanto más elevada la exposición, mayor fue el %MMA y menor el de DMA urinarios, con lo cual es mayor el riesgo de enfermedad de estas poblaciones. La edad, el género y la presencia del polimorfismo T860C también mostraron tener influencia sobre el metabolismo del As. La existencia de poblaciones con niveles de exposición tan elevados aumenta, no linealmente sino exponencialmente, el riesgo de desarrollar las patologías relacionadas al As (122).
Un trabajo reciente llevado a cabo por un grupo de investigadores locales, señala la influencia del nivel de exposición del As sobre el perfil metabólico urinario (%AsI, %MMA y %DMA), en poblaciones crónicamente expuestas de la región Chaco-Pampeana, y cómo afecta la presencia del polimorfismo T860C en el gen que codifica la arsenito-metiltransferasa y la relación con el genotipo [salvaje (WT) o heterocigoto (H)] de la población estudiada. Los niveles de excreción urinaria de As estuvieron comprendidos entre 18 mg/g a 4103 mg/g de creatinina. Se halló además una clara influencia de la edad, sexo y nivel de exposición (122) la influencia de la presencia del polimorfismo T860C sobre el perfil metabólico del As (123). La influencia del nivel de exposición mostró diferencias entre individuos portadores de los genotipos tipo WT y el H. El perfil metabólico de individuos portadores del genotipo WT está influenciado por el nivel de exposición, mientras que los individuos con el genotipo H no lo están. Los autores concluyen que el nivel de exposición parece tener una influencia significativa en el perfil metabólico urinario (aumento del % MMA) de individuos portadores del genotipo WT.
En contraste, los individuos que portan el genotipo H no modificarían el perfil de excreción (% MMA) por el aumento del nivel de exposición al As (122). Habitantes de San Antonio de los Cobres, en general son portadores de un haplotipo de la AS3MT relacionado con una reducción del riesgo para la salud debido a la rápida excreción del As y una menor eliminación del metabolito monometilado (MMA). En la población estudiada, se encontró una significativa alta frecuencia
del haplotipo de la AS3MT comparado con diferentes grupos de indígenas. Aún cuando la estratificación de la población fue insuficiente (346 vs. 122), estos datos sugieren la posibilidad de que, durante miles de años, haya ocurrido una selección natural para tolerar el estrés ambiental al As aumentando la frecuencia de las variantes protectoras de la AS3MT. Los autores estiman que se necesitan más estudios para confirmar esta hipótesis (124).
La etnia puede jugar un papel clave y proporciona información relevante para poblaciones heterogéneas por lo cual se realizó un trabajo caracterizando un grupo de 70 niños de escuelas rurales de las provincias del Chaco y Santiago del Estero que estuvieron expuestos a altos niveles de As. Los resultados demuestran que los linajes maternales amerindios están presentes en el 100% de las muestras, mientras que el componente amerindio transmitido a través de la línea paterna es menos del 10%. El análisis de correlación demostró que el origen étnico y la proporción de los metabolitos del AsU, MMA y DMA no están asociados. Las diferencias metabólicas, serían parte de un proceso de adaptación a las condiciones ambientales (125).
ALTERACIONES DEL PERFIL METABÓLICO Y SALUD INFANTIL
Varios estudios se centraron en los efectos del As y de sus metabolitos sobre la reproducción en Argentina. Un importante estudio realizado en 11 mujeres embarazadas en el noroeste de Argentina, mostró que el As (200 μg /L en el agua potable) atraviesa fácilmente la placenta lo cual planteó preocupación por la exposición fetal. Al final de la gestación el 90% el AsU fue DMA en comparación con el 70% en mujeres no embarazadas (p<0,001) (39). La metilación del As está aumentada durante el embarazo siendo el DMA la especie mayormente transferida el feto (38) (39) (126).
Mediciones de As en leche materna indican que a alta exposición (As en el agua de bebida ~200 μg/L), la concentración en 10 muestras se encontró en baja concentración (2,3 μg/kg ph) (39). Estos hallazgos sugieren que las medidas de protección se producen durante el embarazo y después del parto asegurando que no aparezcan efectos adversos para la salud infantil (38) (39). En el mismo estudio fueron evaluadas 96 mujeres y niños de dos pueblos en el norte de Argentina (Rosario de Lerma), uno con alto As en el agua de bebida (200 μg/L) y el otro con baja exposición (0,65 μg As/L). Los niños tuvieron un % de AsI urinario significativamente más elevado que las mujeres (50%% vs. 32%) siendo además considerablemente mayores que los resultados obtenidos en otros grupos no expuestos estudiados (13% en niños). De acuerdo a los autores, esto indicaría que los niños serían menos sensibles que los adultos a la toxicidad inducida por el As ya que los metabolitos metilados se unen menos a los constituyentes de los tejidos que el AsI. En los niños, el % de AsI en la orina disminuyó, mientras que el % deDMA aumentó, indicando esto una inducción de la metilación con el aumento de la exposición actuando así como mecanismo de protección.
Biomarcadores de efecto,
genotoxicidad y daño al DNA
A pesar del conocimiento del efecto genotóxico y carcinogenético del As en la población humana, son pocos los trabajos publicados en Argentina, pero sus resultados ponen de manifiesto sus deletéreos efectos. Un aumento significativo del intercambio de cromátidas hermanas fue descripto en población argentina que consumía agua con As en una concentración de 130 μg/L (127).
Otro trabajo señala que los resultados de pruebas de genotoxicidad en individuos de Santiago del Estero expuestos a As, donde las concentraciones de As en el agua de bebida fueron elevadas, presentaron aumento en el índice mitótico, un incremento en la inestabilidad cromosómica evaluado por el test de intercambio de cromátidas hermanas, observándose modificaciones en el índice de replicación, obtenido por mediciones de la cinética de proliferación celular, y un incremento en la frecuencia de micronúcleos, evidenciando el efecto de aneunogenicidad y/oclastogenicidad del As (10)(11).
Muestras de orina y sangre fueron recolectadas de una población de la provincia de Santiago del Estero evaluándose en las primeras el contenido de AsU como marcador de exposición y el daño producido al ADN mediante el ensayo de electroforesis de células únicas (test del cometa) en sangre como índice de genotoxicidad. De la población total estudiada (n=65), el 41,54% fueron niños. El 57% de la población infantil presentó valores de AsU superiores al valor máximo de referencia (hasta 40 μg/g creatinina) con un valor máximo de 3918,1 μg/g creatinina. La evaluación genotóxica en sangre reveló que los niños expuestos a elevados niveles de As presentaron un porcentaje de células con alto daño al ADN significativamente mayor comparado con aquellos con AsU menores al valor de referencia (32,79 ± 3,32 % vs. 9,77 ± 6,59%; p<0,001) (5)(108). Además se halló correlación entre el porcentaje de daño al ADN (test cometa) y la excreción urinaria de la población con alta y baja exposición (r= 0,66 p<0,005) (108).
Bartolotta et al. (129) determinaron el potencial riesgo genotóxico asociado con la exposición ambiental a As inorgánico a través del agua potable, evaluando la frecuencia de micronúcleos (MN) en células bucales exfoliativas en poblaciones rurales de Santiago del Estero y en poblaciones urbanas de Buenos Aires. El grupo expuesto en Santiago del Estero (en las localidades La Firmeza y Santos Lugares) mostró un aumento significativo en la frecuencia de MN en las células en comparación con los controles no expuestos (Monte Quemado y Urutaú) (p=0,0005) y en los grupos de Buenos Aires, los individuos de Navarro (grupo expuesto) mostró una diferencia significativa en comparación con los controles provenientes de la Ciudad Autónoma de Buenos Aires (p=0,0002).
En otras publicaciones sobre investigaciones realizadas también en residentes de Santiago del Estero, se determinó el nivel de exposición mediante el contenido de As en muestras de orina (n=32) de una región de hidroarsenicismo y sobre muestras de descamación bucal se valoró la frecuencia de MN. Los resultados fueron comparados con la frecuencia de MN en personas no-expuestas al As (n=8) resultando que los pobladores de la región endémica tuvieron una elevada exposición al AsI (AsU=1665 μg/g creat., rango 224-3684), significativamente diferente (p<0,0001) a la de los pobladores no expuestos (AsU=15 μg/g creat., rango 8-25) y que la frecuencia de MN fue superior (p<0,01) en la población expuesta (valor medio: 4,1±0,5 MN/1000 células vs. no expuestos: 2,1±0,7 MN/1000 células). Además se observó una reducción de células micronucleadas a niveles de exposición muy elevados (> 1000 μg/L en el agua de bebida), posiblemente por la iniciación de procesos apoptóticos debido a la alta toxicidad del As (5) (107).
Relación entre exposición al As y desarrollo de cáncer y de otras patologías no-carcinógenas y evaluaciones del riesgo carcinógeno
RELACIÓN EXPOSICIÓN AL ARSÉNICO, DESARROLLO DE CÁNCER Y EVALUACIONES DEL RIESGO CARCINÓGENO
Desde la década del 90, investigaciones realizadas en Argentina y en otros países, han demostrado los efectos carcinógenos por la exposición al As. Aunque gran parte de los hallazgos se basaron en estudios retrospectivos de casos y controles o estudios ecológicos que carecían de los datos individuales de exposición, se encontró consistente asociación entre exposiciones a altas concentraciones de As en el agua de bebida y el riesgo de cáncer (129) (130).
Se encontró alta mortalidad por cáncer de vejiga, pulmón y riñón asociado a exposición arsenical en el agua de bebida en la provincia de Córdoba (129) (131).
Un estudio de caso se llevó a cabo en Argentina y Chile, en el cual se examinaron alteraciones cromosómicas en casos de tumores de vejiga en 123 individuos expuestos al As en el agua de bebida. Los tumores de vejiga en los individuos con niveles más altos de exposición al As mostraron mayores niveles de inestabilidad cromosómica.
La mayoría de las alteraciones cromosómicas asociadas con la exposición al As también se asociaron con el estadío y el grado de avance tumoral, aumentando la posibilidad de que los tumores de vejiga de los sujetos expuestos al As se comporten más agresivamente que los tumores de individuos no expuestos (132).
Estudios realizados entre 1996 y 2000 en la provincia de Córdoba, señalan un aumento de la mortalidad por cáncer de vejiga cuando las aguas de pozos están contaminadas con concentraciones moderadas de As. Cuando los autores utilizaron el consumo de agua de pozo como medida de la exposición, y una ventana de tiempo para el uso del agua de pozo de más de 50 años antes de la entrevista, se observó asociación con un mayor riesgo de desarrollo de cáncer de vejiga. Este estudio sugiere un menor riesgo de cáncer de vejiga para el As que las previstas en otros estudios, pero se suma a la evidencia de que la latencia para los cánceres de vejiga inducidos por el As puede ser más largo de lo que se pensaba (133).
Otro trabajo realizado en habitantes de San Antonio de los Cobres (114 expuestos y 114 no-expuestos) y residentes en EE.UU. (23 casos y 49 controles) evaluó los productos de metilación del AsU, resultando que aquellos individuos expuestos al As que excretan una alta proporción de MMA son más susceptibles de desarrollar un cáncer asociado a la exposición arsenical (119).
En una investigación realizada en Córdoba se halló elevada mortalidad de cáncer de riñón, tanto en hombres como mujeres, expuestos a As en el agua (178 μg/L). Este estudio sugiere que el riesgo de cáncer de riñón alcanzó su punto máximo alrededor de los 10 años y se mantuvo elevado durante al menos 25 años después de cesada la exposición a alto nivel de As en el agua de bebida. La ingesta de As aumenta el riesgo de cánceres de pulmón y riñón pero no hallaron una clara asociación entre exposición al As y mortalidad por cáncer de piel o hígado (131).
Varias investigaciones se han centrado en realizar evaluciones de riesgo a fin de evaluar el aumento de los riesgos del cáncer de vejiga y otros cánceres, y más recientemente, la exploración de la forma en que podría estar relacionada la exposición con los marcadores de susceptibilidad cómo es el factor de crecimiento transformante-α (TGF-α) (115), o cómo el polimorfismo modifica el metabolismo (133) y cómo aumentan las aberraciones cromosómicas y los micronúcleos inducidos por la exposición crónica al As (5) (132).
La mortalidad promedio (defunciones/100.000 habitantes) por tumores carcinógenos en la Provincia de Buenos Aires fue mayor en los varones que en las mujeres: vías respiratorias (310 frente a 76), vías urinarias (44 frente a 11) y piel (21 frente a 11), respectivamente. Las concentraciones de As en aguas de bebida (n= 152) de 52 localidades de la provincia de Buenos Aires se ubicaron en un rango amplio, desde 0,3 hasta 187 μg/L, con una mediana de 40 μg/L. El 82% de las muestras presentaron niveles de As superiores al valor límite aceptable de 10 μg/L, y más de la mitad de ellas provenían de agua de red. Las zonas de mayor concentración de As y pobreza, junto con la falta de agua de red, presentaron un riesgo relativo incrementado de 2 a 4 veces (76).
También en el departamento Comandante Fernández, de la Provincia del Chaco, Fernández et al. (55), realizaron una evaluación del riesgo carcinogénico (R), obteniendo para el As un valor mayor a 1 caso cada 10.000 habitantes para el 82,2% de la población y mayor a 1 caso cada 1.000.000 de habitantes para el 100% de la población. Los resultados de la evaluación de mas de 600 individuos de la 19 localidades de la llanura Chaqueña, permitió evaluar el riesgo carcinogénico, resultando que más del 50% de las localidades presentaron un coeficiente de peligrosidad mayor a 1 y un elevado riesgo carcinogénico en el 74% de las localidades. Es esperable un mayor número de casos de cáncer, debido a la exposición al As, en los centros urbanos por ser los sitios más densamente poblados. Estos resultados califican a la región como de urgencia ambiental y de salud pública (76).
De 118 mediciones de arsénico en agua la población rural de Máximo Paz, desde 2001 hasta 2005 inclusive, 29 exceden 0,050 mg/L, indicando que la población está expuesta a concentraciones de arsénico en el agua de bebida por encima de los límites recomendados. La dosis de exposición calculada excede en tres veces la dosis de referencia de IRIS, que es 3×10-4 mg/kg/día. La exposición a esta dosis sugiere que 1,5 casos de cáncer de piel pueden suceder cada 1000 habitantes (69).
RELACIÓN ENTRE LA EXPOSICIÓN AL ARSÉNICO Y OTRAS PATOLOGÍAS NO-CARCINÓGENAS
En el departamento Comandante Fernández de la Provincia del Chaco, Fernández et al. (55), realizaron una evaluación del riesgo no-carcinógeno (HQ) en función a la exposición arsenical y encontraron que fue mayor a 1 para el 93% de los residentes. De acuerdo a estos resultados la presencia de As en las aguas subterráneas destinadas al consumo humano, representan un alto riesgo para la salud de los pobladores que residen en la zona.
Poco se ha investigado en la población argentina expuesta crónicamente al As, la incidencia de otras patologías tales como la diabetes mellitus, cardiopatías, alteraciones vasculares o neuropatías sensorio-motoras, entre otras.
Son necesarias investigaciones en residentes de Argentina a fin de evaluar la incidencia de estas otras patologías no bien conocidas como consecuencia de la exposición arsenical.
RELACIÓN EXPOSICIÓN AL ARSÉNICO, EMBARAZO Y NEONATOS
Los recién nacidos son más sensibles a los efectos deletéreos del As. Si sus madres han estado expuestas al As durante la etapa gestacional, son inevitables en los neonatos ciertas alteraciones como trastornos cardíacos irreversibles, conductuales, cognitivos y discapacidades motoras. Además, la exposición arsenical induce estrés oxidativo, disminución de la producción de ATP, provocando inmadurez estructural y funcional de las células nerviosas, lo que lleva a un desarrollo del cerebro inadecuado o a una alteración del comportamiento (134). Son escasos los trabajos sobre estos efectos en población humana argentina.
La exposición durante el embarazo ha provocado efectos adversos sobre la reproducción en las madres y trastornos en el desarrollo cognitivo de los niños estudiados (126)(135).
Estudios recientes han examinado los posibles mecanismos de toxicidad que provocan efectos adversos para la salud, incluyendo la genotoxicidad, el estrés oxidativo y la reparación del daño (107)(108)(112)(117)(136)(137).
Conclusiones
Es evidente la amplia información existente en Argentina sobre la identificación de regiones con hidroarsenicismo y de las concentraciones de las fuentes de aguas para el consumo humano. Además del problema de la ingesta de aguas arsenicales, ha cobrado importancia el aporte de los alimentos a la ingesta total, especialmente cuando éstos son preparados con aguas contaminadas, y la importante bioaccesibilidad del As inorgánico presente en estos alimentos de acuerdo a los datos existentes.
Una serie de estudios realizados en América Latina no sólo han ayudado a vincular la exposición al As y los efectos adversos sobre la salud, sino también explorando los mecanismos de la aparición de enfermedades subyacentes y las susceptibilidades individuales. Los abundantes estudios realizados en población humana residente en el país, han permitido contar con herramientas para evaluar los factores que afectan la suceptibilidad a enfermar tales como biomarcadores, polimorfismos, geno y fenotipos, niveles de exposición, entre otros, como consecuencia a la ingesta crónica de arsénico.
Asimismo se desprenden de esta revisión los aportes de nuevos indicadores y bioindicadores que permitirán evaluar las variables que afectan la toxicidad del As en los seres humanos, a fin de estimar adecuadamente el impacto sobre la salud y ayudar a prevenir la patología propia de este tóxico.
No cabe duda de la alta exposición al As y del alto riesgo de desarrollar cáncer, u otras enfermedades, de las poblaciones argentinas de zonas de HACRE, lo que ha quedado demostrado por los trabajos aquí citados. Urge abastecer de agua segura a los habitantes de estas regiones. Toda la información recabada no hace más que calificar a las regiones de HACRE en Argentina como de urgencia ambiental y señalar la gravedad del problema de salud pública, lo cual requiere una definitiva solución.
Referencias bibliográficas
- Astolfi E, Maccagno A, Fernández JC, Vaccara R, Stimola R. Relation between arsenic in drinking water and skin cancer. Biolog Trace Elem Res 1981; 3: 133-43.
- Goyenechea M. Sobre la nueva enfermedad descubierta en Bell-Ville. Rev Med Rosario 1917; 7: 485-9.
- Ayerza A. Arsenicismo regional endémico. Conferencia en la Academia de Medicina, La Prensa Médica Argentina (Buenos Aires) 1917; IV: 170-1.
- Ayerza A. Arsenicismo regional endémico (keratodermia y melanodermia combinadas). Bol Acad Nac Medicina 1918; 2-3: 1-55.
- Navoni JA. Toxicidad del arsénico: Evaluación de riesgo en poblaciones expuestas crónicamente al arsénico. [Tesis doctoral]. Facultad de Farmacia y Bioquímica- Universidad de Buenos Aires; 2012.
- WHO- World Health Organization. Guidelines for drinking- water quality. 2nd ed. Geneva, Switzerland. 1993, [Fecha de acceso 17 Jul 2014]; vol. 1, [65 pages]. Disponible en: www.who.int/water sanitation_health/ dwq/gdwq2v1/en/.
- WHO-World Health Organization. Guidelines for Drinking- Water Quality. Recommendations. 3a ed. Geneva,Switzerland. 2004, [Consulta 17 Jul 2014]; vol. 1, [668 pages]. Disponible en: www.who.int/ water_sanitation_ health/dwq/fulltext.pdf?ua=1.
- WHO-World Health Organization. Guidelines for Drinking Water Quality. 4th ed.Geneva, Switzerland. 2011,[Consulta 17 Jul 2014]; [564 pages]. Disponible en: www.who.int/water_sanitation_health/publications/2011/ dwq_ guidelines/en/.
- McClintock TR, Chen Y, Bundschuh J, Oliver JT, Navoni J, Olmos V, et al. Arsenic exposure in Latin America: Biomarkers, risk assessments and related health effects. Sci Total Environ 2012; 429: 76–91.
- Swiecky C, García SI, Villaamil Lepori EC. Epidemiología del Hidroarsenicismo Crónico Regional Endémico (HACRE) en la República Argentina. UnIDA, CONAPRIS, ATA, Eds. 2006, [Fecha de acceso: 2 Jul 2007]; [200 pages]. Disponible en: www.msal. gov.ar/htm/site/pdf/Anexo%20XII%20ECM%20 Hidroarsenismo_ WEB.pdf.
- Curto SI, Mendiburo NA, Plastina R, Boffi R. Arsénico en acuíferos: influencia sobre la salud de la población. 2001, [Fecha de acceso: 14 Ag 2007]; [6 pages]. Disponible en: www.ambiente.gov.ar/ archivos/ web/salud_ambiente/File/2001%20Ars%20nico%20 en%20Acuferos%20y%20Salud.pdf.
- Ravenscroft P, Brammer H, Richards KS. Health effects of arsenic in drinking water and food in arsenic pollution: A global synthesis. London: Wiley-Blackwel. 2009. p. 157-212.
- IARC. Monographs on the Evaluation of Carcinogenic Risks to Humans. Some Drinking-water Disinfectants and Contaminants, including Arsenic. 2004, [Fecha de acceso: 10 Jul 2005]; 84, p. 1-19. Disponible en: http://monographs.iarc.fr/ENG/Monographs/vol84/volumen84. pdf.
- Corey G, Tomasini R, Pagura J. Estudio epidemiológico de la exposición al arsénico a través del consumo de agua. Provincia de Santa Fe, República Argentina. 2005, [Fecha de acceso: 25 Sep 2013]; [24 pages]. Disponible en: www.cofes.org.ar/descargas/info_sector/Arsenico/Estudio_epidemiologico _arsenico_ENRESS_
LA.pdf. - Castro de Esparza ML. Presencia de arsénico en el agua de bebida en América Latina y su efecto en la salud pública. Proceedings of the International Congress: Natural Arsenic in Groundwaters of Latin America. México. 2006, [Fecha de acceso: 23 Nov 2006]; [14 pages]. Disponible en: www.bvsde.ops-oms.org/ bvsacd/ cd51/arsenico-agua.pdf.
- CAA – Código Alimentario Argentino. Capítulo XII -Bebidas hídricas, agua y agua gasificada. Agua potable Artículo 982 – Resolución Conjunta SPRyRS y SAGPyA N° 68/2007 y N° 196/2007. [Fecha de acceso 12 Nov 2007] Disponible en: www.anmat.gov.ar/ alimentos/codigoa/Capitulo_XII.pdf 12/09/13.
- CAA – Código Alimentario Argentino. Capítulo XII -Bebidas hídricas, agua y agua gasificada. Agua potable Artículo 982 –Resolución Conjunta SPReI N° 34/2012 y SAGyP N° 50/2012. [Fecha de acceso: 27 Mar 2013] Disponible en: www.anmat.gov.ar/alimentos/ codigoa/CAPITULO_XII.pdf.
- Smedley PL, Kinniburgh DG. A review of the source, behaviour and distribution of arsenic in natural waters. Appl Geochem 2002; 17: 517–68.
- Litter MI, Pérez Carrera AL, Fernández Cirelli A, Ingallinella AM, Sancha Fernández, AM, Nicolli HB, et al. El problema del arsénico en el Mercosur. Un abordaje Integrado y multidisciplinar en la investigación y desarrollo para contribuir a su resolución. Tecnologia para o desenvolvimento sustentável. Edição 2011 do prêmio MERCOSUL de ciência e Tecnologia. Brasília- Brasil. 2011, [Fecha de acceso: 23 Jul 2012]; [30 pages]. Disponible en: www.idi.mineco.gob.es/stfls/ MICINN/ Investigacion/FICHEROS/Mercosur.pdf.
- Nicolli HB, Bundschuh J, Blanco MC, Tujchneider OC, Panarello HO, Dapeña C, et al. Arsenic and associated trace-elements in groundwater from the Chaco-Pampean plain, Argentina: results from 100 years of research.
Sci Total Environ 2012; 429: 36-56. - Choque D, Quiquin A, Bovi Mitre G, Navoni J, Villaamil Lepori E. Intake estimated of inorganic arsenic and bioaccessible fraction in the diet from Pastos Chicos, Susques, Argentina. Preliminary study. En: Litter MI, Nicolli HB, Meichtry JM, Quici N, Bundschuh J, Bhattacharya P, Naidu R, eds. As2014. Proceedings of the 5th International Congress on Arsenic in the Environment: One Century of the Discovery of Arsenicosis in Latin America (1914-2014.) 2014, May 11-16; Buenos Aires, Argentina. London: CRC Press, Taylor y Francis Group. 2014. p. 419-20.
- Navoni JA, Olmos V. Hidroarsenicismo Crónico Regional Endémico: una problemática actual y no resuelta en Argentina. Portal de la página Web de la Facultad de Farmacia y Bioquímica-Universidad de Buenos Aires. 2012, [Fecha de acceso: 28 Ag 2012]. Disponible en: http://www.ffyb.uba.ar/ gxpsites/hgxpp001.aspx?2.
- Bundschuh J, Farías B, Martin R, Storniolo A, Bhattacharya P, Cortes J, et al. Groundwater arsenic in the Chaco-Pampean Plain, Argentina: case study from Robles county, Santiago del Estero Province. Appl Geochem 2004; 19: 231–43.
- Bundschuh J, Nicolli HB, Blanco M del C, Blarasin M, Farías SS, Cumbal L, et al. Distribución de arsénico en la región sudamericana. En: Bhattacharya P, Welch AH, eds. Distribución del arsénico en las regiones Ibérica e Iberoamericana. Buenos Aires: Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. 2008. p. 137–86.
- Bundschuh J, Garcia ME, Birkle P, Cumbal LH, Bhattacharya P, Matschullat J. Occurrence, health effects and remediation of arsenic in groundwaters of Latin America. En: Bundschuh J, Bhattacharya P, eds. Arsenic in the environment. Natural arsenic in groundwater, Vol 1. London UK: CRC Press. 2008. p. 3-15.
- Bundschuh J, Litter MI, Nicoli HB, Hoinkis J, Bhattacharya P. Identifying occurrences of groundwater arsenic in Latin America: a continent wide problem and challenge. Proceedings of the 3rd International Congress: Arsenic in the environment, Arsenic in geosphere and human disease. As2010. 17-21 mayo, 2010. Tainan-Taiwan, London-UK. Tylor and Francis Group. 2010. p. 512–6.
- Bundschuh J, Nath B, Bhattacharya P, Liu C-W, Armienta MA, Moreno López MV, et al. Arsenic in the human food chain: the Latin American perspective. Sci Total Environ 2011; 429: 92–106.
- Nicolli HB, Suriano JM. Gómez Peral MA, Ferpozzi LH, Baleani OM. Groundwater contamination with arsenic and other trace elements in an area of the Pampa, Province of Córdoba, Argentina. Environ Geol Water Sci 1989; 14(1): 3–16.
- Pérez-Carrera A, Fernández-Cirelli A. Arsenic concentration in water and bovine milk in Cordoba, Argentina. Preliminary results. J Dairy Res 2005; 72(1): 122-4.
- Benítez ME, Giménez MC, Osicka RM, Garro OA. Arsénico en aguas naturales subterráneas en la región central de la Provincia del Chaco. [Resumen]. 2002, [Fecha de acceso: 29 Jun 2013]; [3 pages]. Disponible en: www.ambiente.gov.ar/archivos/web/salud ambiente/File/Aguas%20Arsenicales%20 en%20Chaco% 20Central.pdf.
- Blanes PS, Buchhamer EE, Giménez MC. Natural contamination with arsenic and other trace elements in groundwater of the Central-West region of Chaco, Argentina. J Environ Sci Health A Tox Hazard Subst Environ Eng 2011; 46(11): 1197-206.
- Bhattacharya P, Claesson M, Bundschuh J, Sracek O, Fagerberg J, Jacks G, et al. Distribution and mobility of arsenic in the Rio Dulce alluvial aquifers in Santiago del Estero Province, Argentina. Sci Total Environ 2006; 358: 97-120.
- Smedley PL, Kinniburgh DG, Macdonald DMJ, Nicolli HB, Barros AJ, Tullio JO, et al. Arsenic associations in sediments from the loess aquifer of La Pampa, Argentina, Appl Geochem 2005; 20(5): 989-1016.
- Raychowdhury N, Mukherjee A, Bhattacharya P, Johannesson K, Bundschuh J, Bejarano Sifuentes G, et al. Provenance and fate of arsenic and other solutesin the Chaco-Pampean Plain of the Andean foreland, Argentina: From perspectives of hydrogeochemical modeling and regional tectonic setting. Journal of Hydrology. 2013, [Consulta 2 Jul 2014]; [17 pages]. DOI: 10.1016/j.jhydrol. 2013.07.003.
- Fernández-Turiel JL, Galindo G, Parada MA, Gimeno D, García-Vallès M, Saavedra J. Estado actual del conocimiento sobre el arsénico en el agua de Argentina y Chile: origen, movilidad y tratamiento. En: Galindo G, Fernández-Turiel JL, Parada MA, Gimeno Torrente D, eds. Arsénico en aguas: origen, movilidad y tratamiento. Taller. II Seminario Hispano-Latinoamericano sobre temas actuales de hidrología subterránea y IV Congreso Hidrogeológico Argentino. Río Cuarto, Argentina, 25-28 octubre 2005, [Fecha de acceso: 5 mar 2006]. 2005. p. 1-22. Disponible en: http:// digital.csic.es/ bitstream/10261/ 4019/1/Galindo_ et_al-Arsenico-2005.pdf.
- De Pietri DE, Navoni JA, Olmos V, Giménez C, Bovi Mitre G, de Titto E. Geospatial human health risk assessment in an Argentinean region of hidroarsenicism En: Litter MI, Nicolli HB, Meichtry JM, Quici N, Bundschuh J, Bhattacharya P, Naidu R, eds. As2014. Proceedings of the 5th International Congress on Arsenic in the Environment: One Century of the Discovery of Arsenicosis in Latin America (1914-2014.) 2014, May 11-16; Buenos Aires, Argentina. CRC Press, Taylor y Francis Group. London. 2014. p. 597-601.
- Concha G, Broberg K, Grander M, Cardozo A, Palm B, Vahter M. High-level exposure to lithium, boron, cesium, and arsenic via drinking water in the Andes of northern Argentina. Environ Sci Technol 2010; 44: 6875–80.
- Concha G, Nermell B, Vahter M. Metabolism of inorganic arsenic in children with chronic high arsenic exposure in northern Argentina. Environ Health Perspect 1998; 106: 355–9.
- Concha G, Vogler G, Lezcano D, Nermell B, Vahter M. Exposure to inorganic arsenic metabolites during early human development. Toxicol Sci 1998; 44: 185–90.
- Concha G, Nermell B, Vahter M. Spatial and Temporal Variations in Arsenic Exposure via Drinking-water in Northern Argentina. J Health Popul Nutr 2006; 24: 317–26.
- Farías S, Bianco de Salas G, Servant RE, Mitre BG, Escalante J, Ponce RI, et al. Survey of arsenic in drinking water and assessment of the intake of arsenic from water in Argentina Pune. En: Bundschuh J, Bhattacharya P, eds. Natural arsenic in groundwater. Arsenic in the environment. Volume 1. Natural arsenic in groundwater. Leiden, Países Bajos. CRC Press/ Balkema Publisher. 2009. p. 397-407.
- Paoloni JD, Sequeira ME, Fiorentino CE. Mapping of arsenic content and distribution in groundwater in the southeast Pampa, Argentina. J Environ Health 2005; 67(8): 50–3.
- Nicolli HB, Tineo A, García JW, Falcón CM. Caracterización hidrogeoquímica y presencia de arsénico en las aguas subterráneas de la cuenca del río Salí, provincia de Tucumán, Argentina. En: Galindo G, Fernández-Turiel JL, Parada MA, Gimeno Torrente D, eds. Arsénico en aguas: origen, movilidad y tratamiento. Taller. II Seminario Hispano- Latinoamericano sobre temas actuales de hidrología subterránea y IV Congreso Hidrogeológico Argentino. Río Cuarto, Argentina. 25- 28 octubre de 2005, [Fecha de acceso: 5 mar 2006]. 2005. p. 93-102. Disponible en: http://digital.csic.es/ bitstream/10261/4019/1/Galindo_ et_al-Arsenico-2005.pdf.
- Nicolli HB, Tineo A, García JW, Falcón CM, Merino MH. Trace-element quality problems in groundwater from Tucumán, Argentina. En: Cidu R, ed. Water-Rock Interaction, 2. Proceedings of the 10th International Symposium on Water-Rock Interaction. 10-15 July, 2001; Villasimius, Italy. Leiden, The Netherlands: CRC Press/Balkema, Publisher. 2001. p. 993-6.
- De Sastre MS, Varillas A, Kirschbaum P. Arsenic content in water in the northwest area of Argentina. Proceedings of the International Seminar on Arsenic in the Environment and Its Incidence on Health. Sancha A, ed. 25–29 May 1992. Santiago, Chile. 1992. p. 91-99.
- Medus M, Mariño E, Schulz C. Variación temporal de los contenidos de arsénico en la batería de pozos que abastece a General Pico, La Pampa, Argentina. En: Galindo G, Fernández-Turiel JL, Parada MA, Gimeno Torrente D, eds. Arsénico en aguas: origen, movilidad y tratamiento. Taller. II Seminario Hispano-Latinoamericano sobre temas actuales de hidrología subterránea y IV Congreso Hidrogeológico Argentino. Río Cuarto, Argentina. 25- 28 octubre de 2005, [Fecha de acceso: 5 mar 2006]. 2005. p. 73-82. Disponible en: http://digital.csic.es/bitstream/10261/4019/1/Galindo_ et_al-Arsenico-2005.pdf.
- O’Reilly J, Watts MJ, Shaw RA, Marcilla AL, Ward NI. Arsenic contamination of natural waters in San Juan and La Pampa, Argentina. Environ Geochem Health 2010; 32 (6): 491–515.
- Fiorentino C, Sequeira M, Paoloni D, Echeverría N. Detección y distribución de arsénico, flúor y boro en aguas subterráneas regionales. Mapas de Riesgo. [Resumen en Actas]. Congreso Nacional del Agua, Agosto-setiembre, 1998; Santa Fe, Argentina. 1998. p. 71–9.
- Blanes PS, Giménez MC, Herrera Ahuad CE. Arsénico y otros elementos traza en aguas subterráneas en la región central de la provincia del Chaco. [Resumen]. Universidad Nacional del Nordeste. Comunicaciones Científicas y Tecnológicas. 2004, [Fecha de acceso: 3 Feb 2012]; [4 pages]. Disponible en: http://www.unne.edu. ar/unnevieja/Web/cyt/com 2004/8-Exactas/E-070.pdf.
- blanes PS, Giménez MC. Evaluación de los Niveles de Hierro y Arsénico en Aguas Naturales Subterráneas de la Región Centro-Oeste de la Provincia del Chaco – Argentina. Información Tecnológica, 2006; 17 (3): 3-8.
- Giménez MC, Blanes P, Buchhamer EE, Osicka RM, Morisio Y, Farías SS. Assessment of Heavy Metals Concentration in Arsenic Contaminated Groundwater of the Chaco Plain, Argentina. ISRN Environmental Chemistry. 2013, [Fecha de acceso: 11 Jul 2014]; [12 pages]. Article ID 930207. Disponible en: http:// dx.doi.org/10.1155/2013/930207.
- Osicka RM, Agulló NS, Herrera Aguad CE, Jiménez MC. Evaluación de las concentraciones de fluoruro y arsénico en las aguas subterráneas del Domo Central de la Provincia del Chaco. 2002, [Fecha de acceso: 14 Jun 2014]; [3 pages]. Disponible en: http://www. msal.gov.ar/htm/site/pdf/ FyAsChaco.pdf.
- . Blanco MC, Paoloni JD, Morrás H, Fiorentino CE, Sequeira M. Content and distribution of arsenic in soils, sediments and groundwater environments of the Southern Pampa region, Argentina. Environ Toxicol 2006; 21: 561-74.
- Farfán Torres EM, Naranjo PM, Boemo A, Lommiczi I, Lorenzo L. Distribución de As en agua subterránea del Chaco Salteño, Argentina. En: Litter M, ed. Libro de resúmenes del taller de distribución del As en Iberoamérica. Buenos Aires, Argentina. 2006. p. 51-52.
- Fernández NS, Varela NM, Giménez MC. Evaluación del riesgo para la salud por exposición a metales pesados presentes en aguas subterráneas en la región centro chaqueña. Proceedings of the III Jornadas de Investigación en Ingeniería del NEA y países limítrofes: Nuevos escenarios para la ingeniería en el Norte Grande. 9 – 10 de Junio 2014. [Fecha de acceso: 10 Jul 2014]. Resistencia, Chaco. [94 peges]. Disponible en: http://jiim.frre.utn.edu.ar/actas/6MAF/ index.pdf.
- Francisca FM, Cebollada Verdaguer MP, Carro Pérez E. Distribución espacial del arsénico en las aguas Subterráneas de la provincia de Córdoba, Argentina. Libro de resúmenes del VIII Congreso Latinoamericano de Hidrología Subterránea. 25-29 de setiembre 2006, Asunción, Paraguay. [Fecha de acceso: 6 Jul 2014]; [16 pages]. Disponible en: www.efn.uncor.edu/investigacion/ IMPAS/Espanol/papers/ 036 Francisca_et_ al%5B1 %5D.pdf.
- Penedo M, Zigarán A. Hidroarsenicismo en la provincia de Córdoba: Actualización del mapa de riesgo e incidencia. Libro de resúmenes del Congreso Interamericano de Ingeniería Sanitaria y Ambiental, 26 (AIDIS 98), 1-5 nov. 1998, Lima, Perú. [Fecha de acceso: 17 Ag 2010]. 1998. p. 1–20. Disponible en: http://www.bvsde. paho.org/bvsaidis/impactos/peru/argsam 024.pdf.
- Martínez DE, Osterrieth M. Geoquímica de la sílice disuelta en el acuífero Pampeano en la vertiente sudoriental
de Tandilia. Serie Correlación Geológica 13. Libro de resúmenes del II Congreso Argentino de Hidrogeología. San Miguel de Tucumán, Argentina. 1999, [Fecha de acceso: 21 Ag 2013]. 1999. p. 241-250. Disponible en: http://insugeo.org.ar/publicaciones/docs/ scg_ 13/26_martinez. htm. - Nicolli HB, O´Connor TE, Suriano JM, Koukharsky MML, Gómez Peral MA, Bertini LM, et al. Geoquímicadel arsénico y de otros oligoelementos en aguas subterráneas de la Llanura sudoriental de la provincia de Córdoba. Acad. Nac. Ciencias. Córdoba, Argentina. Miscelánea 1985; 71: 1-112.
- Pérez Carrera A, Moscuzza C, Fernández Cirelli A. Aporte de macrominerales del agua de bebida a la dieta de bovinos de leche (Córdoba, Argentina). Revista Argentina de Producción Animal 2005; 25(3-4): 115-121.
- Guber RS, Tefaha L, Arias N, Sandoval N, Toledo R, Fernández M, et al. Contenido de arsénico en el agua de consumo en Leales y Graneros (Provincia de Tucumán, Argentina). Acta Bioquim Clín Latinoam 2009; 43: 201–7.
- Nicolli HB, Tineo A, García JW, Falcón CM, Merino MH, Etchichury MC, et al. Arsenic-contamination source of groundwater from Salí basin, Argentina. In: Water-Rock Interaction, 2. Bullen TD, Wang Y, eds. Proceedings of the 12th International Symposium on Water-Rock Interaction; 31 July – 5 August, 2007, Kunming, China; Leiden, The Netherlands: CRC Press/ Balkema, Publisher; 2007. p. 1237– 40.
- Bocanegra OC, Bocanegra EM, Álvarez AA. Arsénico en las aguas subterráneas: su impacto en la salud. Proceedings of the Congreso Internacional XXXII IAH y VI ALHSUD, Aguas Subterráneas y Desarrollo Humano. 21 al 25 de octubre de 2002, Mar del Plata, Argentina. [Fecha de acceso: 5 Dic 2006]. 2002. p. 21-27. Disponible en: http://www.alhsud.com/public/ articulos/Bocanegra2-Alvarez.pdf.
- Paoloni J, Fiorentino E, Sequeira M, Echeverría N. Spatial variability and concentration of arsenic in the groundwater of a region in the southwest Buenos Aires province, Argentina. J Soil Water Conservation 2002; 55: 436-8.
- Nicolli HB, Blanco MC, Paoloni JD, Fiorentino CE. Ambientes afectados por el arsénico. En: Distribución del arsénico en las regiones Ibérica e Iberoamericana. Bundschuh J, Pérez Carrera A, Litter M, eds. CYTED. Buenos Aires, Argentina. 2008. p. 49-57.
- Galindo G, Herrero MA, Flores M, Fernández Turiel JL. Correlación de metales traza en aguas subterráneas someras de la Cuenca del río Salado, Prov. de Buenos Aires, Argentina. En: Tineo A, ed. Hidrología subterránea: II Congreso Argentino de Hidrogeología y IV Seminario Hispano Argentino sobre temas actuales de Hidrología Subterránea. Serie Correlación Geológica. CONICET: 1999; 13 p. 251-61.
- Blanco MC, Paoloni JD, Morrás H. Caracterización geoquímica del ión arsénico en la fase sólida de suelos de la Región Pampeana Sur, Argentina. En: Galindo G,Fernández-Turiel JL, Parada MA, Gimeno Torrente D, eds. Arsénico en aguas: origen, movilidad y tratamiento. Taller. II Seminario Hispano Latinoamericano sobre temas
actuales de hidrología subterránea y IV Cong. Hidrogeológico Argentino. 25-28 Oct. 2005; Río Cuarto, Argentina. [Fecha de acceso: 5 mar 2006]. 2005. p. 33-40. Disponible en: http://digital.csic.es/bitstream/10261/4019/1/ Galindo_et_al-Arsenico-2005.pdf. - Espósito ME, Paoloni JD, Sequeira ME, Amiotti NM, Blanco MC. Natural contaminants in drinking waters (Arsenic, Boron, Fluorine and Vanadium) in the southern pampean plain, Argentina. J Environ Protec 2011; 2: 97-108.
- Piola J, Navone H, Prada D, Evangelista M, Walkman J. Niveles de exposición a arsénico en agua de bebida y riesgo relativo de cáncer de piel, en Máximo Paz, Santa Fe, Argentina. Período 2001-2005. RETEL, 10, 2006, [Fecha de acceso: 17 Ag 2010]; [18 screens]. Disponible en: http://www.sertox.com.ar/retel.
- Nicolli HB, Tujchneider OC, Paris MC, Blanco MC, Barros AJ. Sources and mobility of arsenic in groudwater from centre-north plain of Santa Fe Province, Argentina. Proceedings of the 2nd. International Congress: Arsenic in the environment: “Arsenic from Nature to Humans”. 21- 23 May, 2008, Valencia, Spain. 2008. p. 75–6.
- González D, Ferrúa N, Cid J, Sansone G, Jiménez I. Arsénico en aguas de San Luis (Argentina). Uso de un equipo alternativo al de Gutzeit modificado. Acta Toxicol Argent 2003; 11(1): 3-6.
- González DM, Ferrúa NH, Sansone MG, Ferrari S, Cid J. Arsénico en agua de consumo humano en poblaciones
de las provincias de San Luis y Buenos Aires. [Resumen]. Acta Toxicol Argent 2004; 12 supl: 7. - Sandali G, Diez E. Determinación del contenido de arsénico en agua de consumo humano en la provincia del Chubut. [Resumen]. Acta Toxicol Argent 2004; 12 Supl: 13-4.
- Farías S, Villaamil E, Bovi G, Paredes G, Biaggini M. Arsénico en agua, un antiguo tema de discusión noresuelto
en Argentina. En: Litter MI, ed. Proceedings of the Taller de distribución del As en Iberoamérica. Argentina, Editorial Programa Iberoamericano de Ciencia y Tecnología para el Desarrollo. 27-30 noviembre, 2006. Buenos Aires. 2006. p. 190- 5. - Vázquez H, Ortolani V, Rizzo G, Bachur J, Pidustwa V. Arsénico en aguas subterráneas. Criterios para la adopción de límites tolerables. Proceedings of the XXVII Congresso Interamericano de Engenharia Sanitária e Ambiental. 3-8 diciembre 2000, Porto Alegre-Brazil. [Fecha de acceso: 17 Ag 2010]; [17 pages]. Disponible en: http:// www.bvsde.paho.org/bvsaidis/caliagua/v-090.pdf.
- Navoni JA, De Pietri D, García S, Villaamil Lepori EC. Riesgo sanitario de la población vulnerable expuesta al arsénico en la provincia de Buenos Aires, Argentina. Rev Panam Salud Pública 2012; 31(1): 1-8.
- Farías S, Perez Arisnabarreta S, Vodopivez C, Smichowski P. Levels of essential and potentially toxic trace metals in Antarctic macro algae. Spectrochimica Acta Part B 2002; 57, 2133– 40.
- Smichowski P, Farías S, Valiente L, Iribarren ML, Vodopivez C. Total arsenic content of nine species of Antarctic macro algae as determined by electrothermal atomic absorption spectrometry. Anal Bioanal Chem 2004; 378(2): 465-9.
- Navoni J, Olivera NM, Villaamil Lepori E. Validación metodológica de la cuantificación de Arsénico por inyección en flujo-generación de hidruros-espectrometría de absorción atómica previa derivatización con l-cisteína (IF-GH-EAA). Acta Toxicol Argent 2009; 17(2): 45–54.
- Astolfi EAN. Estudio de arsénico en aguas de consumo. La Prensa Médica Argentina; 1971; 8: 717-8.
- . Astolfi E, Maccagno A, García Fernández JC, Vaccaro R, Stímola S. Relation between arsenic in drinking water and skin cancer. Biol Trace Elem Res 1981; 3: 133-43.
- Astolfi EAN, Besuschio SC, García Fernández JC, Guerra C, Maccagno A. Hidroarsenicismo crónico regional endémico. Edit. Coop. General Belgrano. Buenos Aires, Argentina. 1982. p. 1- 144.
- Curci OH. Metales. En: Toxicología. Buenos Aires. López Libreros Editores SRL. 1993. p. 65-68.
- Farías SS, Casa VA, Vázquez C, Ferpozzi L, Pucci GN, Cohen IM. Natural contamination with arsenic and other trace elements in groundwaters of Argentine Pampean Plain. Sci Total Environ 2003; 309(1–3): 387–99.
- Castro de Esparza ML. Arsénico en el agua de bebida de América Latina y su efecto en la salud pública. Hojas de divulgación técnica-CEPIS-HDT. 2004, [Fecha de acceso: 23 Nov 2006]; 95. [12 pages]. Disponible en: http://www.ingenieroambiental.com/4014/hdt95.pdf.
- Pérez Carrera A, Fernández Cirelli A. Niveles de arsénico y flúor en agua de bebida animal en establecimientos
de producción lechera (Pcia. de Córdoba, Argentina). Investigación Veterinaria (INVET) 2004; 6 (1): 51-9. - Pérez-Carrera A, Noscuzza C, Fernández-Cireli A. Transfer of arsenic from contaminated dairy cattle drinking water in milk (Córdoba, Argentina). In: Natural arsenic in groundwater of Latin America. In: Bundschuh J, Bhattacharya P, eds. Leiden, the Netherlands: CRC Press/Balkema Publisher. Arsenic in the environment. 2009; 1, p. 419-25.
- Pérez-Carrera A, Fernandez-Cirelli A. Biotransferenceof arsenic from drinking water to bovine tissues and milk. In: Jean JS, Bundschuh J, Bhattacharya P, eds.Proceedings of the As 2010- 3rd International congress arsenic in the environment. May 17– 21, 2010. Tainan, Taiwan. Leiden, the Netherlands: Balkema/ CRC Press; 2010. p. 528–9.
- Ponce R, Farías S, Bovi Mitre G, Vélez D, Montoro R. Determinación de arsénico total e inorgánico en carne y vísceras de camélidos (Lammaglama) autóctonos de la provincia de Jujuy, Argentina. Rev Fac. de Agronomía de la UBA. 2006, [Fecha de acceso: 4 May 2007];26(1):105–109. Disponible en: http://www.Produccionbovina. com/agua_bebida/01-arsenico_carne_llamas. pdf.
- Cabrera A, Blarasin M, Cabrera S, Matteoda E, Gómez ML, Villalba G, et al. Arsénico y flúor en el acuífero freático en el sur de Córdoba: línea de base hidroquímica y problemática ambiental vinculada. En: Galindo G, Fernández-Turiel JL, Parada MA, Gimeno Torrente D, eds. Arsénico en aguas: origen, movilidad y tratamiento. Taller. II Seminario Hispano-Latinoamericano sobre temas actuales de hidrología subterránea – IV Congreso Hidrogeológico Argentino. Río Cuarto, Argentina, 25 al 28 octubre, 2005, [Fecha de acceso: 5 mar 2006]; 2005. p. 41-52. Disponible en: http://digital.csic.es/bitstream/ 10261/ 4019/1/Galindo_ et_al-Arsenico-2005.pdf.
- Nicolli HB, Bundschuh J, García JW, Falcón CM, Jean JS. Sources and controls for the mobility of arsenic in oxidizing groundwaters from loess-type sediments in arid/semi-arid dry climates – Evidence from the Chaco–Pampean plain (Argentina). Water Research, 2010; 44 (19): 5589-604.
- Sigrist M, Beldoménnco H, Repetti MR. Evaluation of the influence of arsenic levels incow’s raw milk from Argentinean dairy farms. Food Chem 2010; 121: 487–91.
- Calatayud M, Ruiz A, Devesa V, Villaamil E, Montoro R, Vélez D. Characterizing arsenic exposure of child populations in Northern Argentina. Proceedings of the 2nd International Congress: Arsenic in the environment: “Arsenic from nature to humans”. May 21-23, 2008 Valencia, Spain. 2008. p. 455-6.
- Torres Escribano S. Bioaccesibilidad de arsénico y mercurio en alimentos con potencial riesgo toxicológico. [Tesis doctoral]. Universitat De València – Departament De Química Analítica – Ed. Servei de Publicacions – Valencia, España. 2011, [Consulta 10 Jul 2014]; [242 pages]. Disponible en: http://www.tdx. cat/bitstream/10803/78990/1/torres.pdf.
- Ávila Carrera N, Calatayud Arroyo M, Navoni J, Giménez C, Bovi Mitre G, Villaamil Lepori E, et al. Arsénico en alimentos argentinos de áreas endémicas: contenidos, bioaccesibilidad y estimación de la ingesta. [Resumen]. Acta Toxicol Argent, 2007; 15 Supl : 68.
- Calatayud M, Devesa V, Vélez D, Bovi Mitre G, Farías S, Giménez M, et al. Evaluation of human exposure to inorganic arsenic in populations of northern Argentina. Proceedings of the Conference 2007 http:// www.physics.harvard.edu/~wilson/arsenic/conferences/ 2007_RGS/2007_RGS_Wilson.pptArsenic: The Geography of a Global problem. Department of Geography Cambridge Universitty. Royal Geographical Society and Institute of British Geographers. 29th August, 2007, [Fecha de acceso: 5 Dic 2007]; London, Reino Unido. [16 screens]. Disponible en: http://www/ users.physics.harvard.edu/~wilson/ arsenic/ conferences/ 2007_RGS/S2.4%20V%20Devesa.pdf.
- Navoni JA, Olivera N, Garcia S, Villaamil Lepori E. Evaluación de riesgo por ingesta de arsénico inorgánico en poblaciones de zonas endémicas argentinas. La Alimentación Latinoam 2007; 270: 66–70.
- Vahter M, Concha G, Nermell B, Nilsson R, Dulout F, Natarajan AT. A unique metabolism of inorganic arsenic
in native Andean women. Eur J Pharmacol Environ Toxicol Pharmacol 1995; 293(4): 455-62. - FAO/WHO- Food and Agriculture Organization of the United Nations – World Health Organization. Expert Committee on Food Additives. Seventy-second meeting, JECFA/72/SC Rome. 2010, [Fecha de acceso: 10 Nov 2011]; [16 screens]. Disponible en: http://www. who.int/foodsafety/chem/summary72_rev. pdf?ua=1.
- ACSA. Agencia Catalana de Seguridad Alimentaria. Arsénico, datos recientes sobre exposición y riesgo.
2010; [Fecha de acceso: 5 Dic 2013]. 2010. p. 1-3. Disponible en: http://www.gencat.cat/salut/acsa/html/ es/dir3226/acsabrief_arsenico.pdf. - EFSA. Scientific opinion on arsenic in food. EFSA Panel on Contaminants in the Food Chain (CONTAM). EFSA, Parma, Italy. EFSA Journal. 2009, [Fecha de acceso: 10 Nov 2010]; 7 (10): 1351, p. 1-198. Disponible en: http://www.efsa.europa.eu/en/efsajournal/ doc/ 1351.pdf.
- Buchhamer EE, Polischuk TE, Navoni J, Giménez MC, Villaamil Lepori EC. Contribución a la dosis de exposición al arsénico inorgánico de un guiso de arroz cocido con agua con arsénico. [Resumen]. Acta Toxic Argent 2013; 21 Sup, 38.
- Klaassen CD, Ed. Casarett & Doull’s.Toxicology. New York, NY: McGraw-Hill; 2001. p. 819-21.
- Hughes MF. Biomarkers of exposure: a case study with inorganic arsenic. Environ Health Perspect 2006; 114:1790-6.
- FAO /OMS-JECFA. Safety evaluation of certain contaminants in food / prepared by the Seventy-second meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). WHO food additives series: 63. Monographs: 8. 2011; 172-4.
- Navoni JA, Pérez, CA, Bongiovanni GA. Especiación de As en cabello humano por SR-XRF-XANES como medida de exposición para valorar los riesgos asociados a su consumo crónico. Book of Abstract of 24th Annual Users Meeting of the Brazilian Synchrotron Light Laboratory (RAU/LNLS). 11-12 marzo 2014, Campinas, SP. Brasil. [Fecha de acceso: 14 Mar 2014]; 2014. p. 24. Disponible en: http://pages. cnpem. br/wpcontent/uploads/2012/09/24RAU_BookofAbstracts. pdf.
- Navoni JA, González Cid M, Elguero ME, Olmos V, Olivera M, Giménez C, et al. Ensayo de micronúcleos en células de exfoliación bucal como biomarcador de efecto en población expuesta a arsénico. [Resumen]. Acta Toxicol Argent 2009; 17 sup: 16.
- Navoni J, González Cid M, Olivera M, Tschambler J, Bovi Mitre G, Larripa I, et al. Daño al ADN asociado al contenido de arsénico urinario en una población de jóvenes expuesta al arsénico por el agua de bebida. Acta Toxicol Argent 2006; 14 sup: 48–51.
- Hopenhayn-Rich C, Biggs ML, Kalman DA, Moore LE, Smith AH. Arsenic methylation patterns before and after changing from high to lower concentrations of arsenic in drinking water. Environ Health Perspect 1996; 104:1200–7.
- Hopenhayn-Rich C, Biggs ML, Smith AH, Kalman DA, Moore LE. Methylation study of a population environmentally exposed to arsenic in drinking water. Environ Health Perspect 1996; 104: 620–8.
- Chung JS, Kalman DA, Moore LE, Kosnett MJ, Arroyo AP, Beeris M, et al. Family correlations of arsenic methylation patterns in children and parents exposed to high concentrations of arsenic in drinking water. Environ Health Perspect 2002; 110: 729-33.
- Engström K, Broberg K, Concha G, Nermell B, Warholm M, Vahter M. Genetic polymorphisms influencing arsenic metabolism: evidence from Argentina. Environ Health Perspect 2007; 115: 599–605.
- Steinmaus C, Moore LE, Shipp M, Kalman D, Rey OA, Biggs ML, et al. Genetic polymorphisms in MTHFR 677 and 1298, GSTM1 and T1, and metabolism of arsenic. J Toxicol Environ Health A. 2007; 70: 159–70.
- Steinmaus C, Moore LE, Shipp M, Kalman D, Rey OA, Biggs ML, et al. Genetic Polymorphisms in MTHFR 677 and 1298, GSTM1 and T1, and Metabolism of Arsenic. J Toxicol and Environ Health, Part A. 2007; 70(2): 159-70.
- Valenzuela OL, Germolec DR, Borja-Aburto VH, Contreras- Ruiz J, Garcia-Vargas GG, Del Razo LM. Chronic arsenic exposure increases TGF alpha concentration in bladder urothelial cells of Mexican populations environmentally exposed to inorganic arsenic. Toxicol Appl Pharmacol 2007; 222: 264–70.
- Concha G, Vogler G, Nermell B, Vahter M. Intra-individual variation in the metabolism of inorganic arsenic. Int.
Arch. Occup Environ Health 2002; 75(8): 576-80. - Engström K, Nermell B, Concha G, Stromberg U, Vahter M, Broberg K. Arsenic metabolism is influenced by polymorphisms in genes involved in one-carbon metabolism and reduction reactions. Mutat Res 2009; 667: 4-14.
- Steinmaus C, Yuan Y, Kalman D, Rey OA, Skibola CF, Dauphine D, et al. Individual differences in arsenic metabolism and lung cancer in a case-control study in Cordoba, Argentina. Toxicol Appl Pharmacol 2010; 247(2): 138-45.
- Steinmaus C, Bates MN, Yuan Y, Kalman D, Atallah R, Rey OA, et al. Arsenic Methylation and Bladder Cancer Risk in Case-Control Studies in Argentina and the United States. J Occup Environ Med 2006; 48(5): 478-88.
- Engström K, Vahter M, Mlakar SJ, Concha G, Nermell B, Raqib R, et al. Polymorphisms in arsenic (+III oxidate state) methyltransferase (AS3MT) predict gene expression of AS3MT as well as arsenic metabolism. Environ Health Perspect 2011; 119: 182–8.
- Li H, Engström K, Vahter M, Broberg K. Arsenic exposure through drinking water is associated with longer telomeres in peripheral blood. Chem Res Toxicol 2012; 25: 2333–9.
- Olmos V, Navoni JA, Villaamil Lepori EC. High level of exposure to arsenic and its influence on arsenic urinary methylated metabolites: A study from Argentina. En: Litter MI, Nicolli HB, Meichtry JM, Quici N, Bundschuh J, Bhattacharya P, Naidu R, eds. As2014. Proceedings of the 5th International Congress on Arsenic in the Environment: One Century of the Discovery of Arsenicosis in Latin America (1914-2014.) May 11- 16, 2014. Buenos Aires, Argentina. CRC Press, Taylor y Francis Group. London. 2014; p. 501-3.
- Olmos V, Navoni JA, Calcagno ML, Sassone AH, Villaamil Lepori EC. Influence of the level of arsenic (As) exposure and the presence of T860C polymorphism in human As urinary metabolic profile. Hum Exp Toxicol. 2014; Published online 20 May 2014, [Fecha de acceso: 14 Jun 2014]; p. 1-9. DOI: 10.1177/0960327114533574.
- Schlebusch CM, Cecil M, Lewis CM, Vahter M, Engström K, Tito RY, et al. Possible Positive Selection for an Arsenic-Protective Haplotype in Humans. Environ Health Perspec 2013; 121 (1): 53-8.
- Bobillo C, Navoni JA, Olmos V, Merini LJ, Villaamil Lepori E, Corach D. Ethnic characterization of a population of children exposed to high doses of arsenic via drinking water and a possible correlation with metabolic processes. Int J Mol Epidemiol Genet 2014; 5(1): 1-10.
- Hopenhayn C, Huang B, Christian J, Peralta C, Ferreccio C, Atallah R, et al. Profile of urinary arsenic metabolites during pregnancy. Environ Health Perspect 2003; 111: 1888–91.
- Lerda D. Sister-chromatid exchange (SCE) among individuals chronically exposed to arsenic in drinking water. Mutat Res 1994; 312: 111–20.
- Bartolotta SA, Pacskowski MG, Hick A, Carballo MA. Micronuclei assay in exfoliated buccal cells from individuals
exposed to arsenic in Argentina. Arch Environ Contam Toxicol 2011; 61: 337–43. DOI: 10.1007/ s00244-010-9607-1. - Hopenhayn-Rich C, Biggs ML, Fuchs A, Bergoglio R, Tello EE, Nicolli H, et al. Bladder cancer mortality associated with arsenic in drinking water in Argentina. Epidemiology 1996; 7(2): 117-124.
- Smith AH, Marshall G, Yuan Y, Ferreccio C, Liaw J, von Ehrenstein O, et al. Increased mortality from lung cancer and bronchiectasis in young adults after exposure to arsenic in utero and in early childhood. Environ Health Perspect 2006; 114: 1293–6.
- Hopenhayn-Rich C, BiggsML, Smith AH. Lung and kidney cancer mortality associated with arsenic in drinking water in Cordoba, Argentina. Int J Epidemiol 1998; 27: 561–9.
- Moore LE, Wiencke JK, Bates MN, Zheng S, Rey OA, Smith AH. Investigation of genetic polymorphisms and smoking in a bladder cancer case–control study in Argentina. Cancer Lett 2004; 211:199–207.
- Bates MN, Rey OA, Biggs ML, Hopenhayn C, Moore LE, Kalman D, et al. Case-Control Study of Bladder Cancer and Exposure to Arsenic in Argentina. Am J Epidemiol 2004; 159 (4): 381–9.
- Gandhi DN, Rakesh K. Arsenic Toxicity and Neurobehaviors: A Review. Innovations Pharmaceuticals Pharmacotherapy 2013; 1(1): 1-15.
- Hopenhayn-Rich C, Browning SR, Hertz-Picciotto I, Ferreccio C, Peralta C, Gibb H. Chronic arsenic exposure and risk of infant mortality in two areas of Chile. Environ Health Perspect 2000; 108: 667-73.
- Dulout FN, Grillo CA, Seoane AI, Maderna CR, Nilsson R, Vahter M, et al. Chromosomal aberrations in peripheral blood lymphocytes from native Andean women and children from northwestern Argentina exposed to arsenic in drinking water. Mutat Res 1996; 370: 151–8.
- Engström KS, Vahter M, Lindh C, Teichert F, Singh R, Concha G, et al. Low 8-oxo-7,8-dihydro-2’-deoxyguanosine levels and influence of genetic background in an Andean population exposed to high levels of arsenic. Mutat Res 2010; 683: 98-105.
Por: Edda Cristina Villaamil Lepori
Farmacéutica, Dra. de la UBA-Área Toxicología, Cátedra de Toxicología y
Química Legal, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires.
Fuente: Acta Bioquímica Clínica Latinoamericana