Explosiones – Definición, Clasificación por Origen
|
DEFINICION
|
Una explosión es un liberación súbita de gas a alta presión en el ambiente. Súbita porque la liberación debe ser lo suficientemente rápida de forma que la energía contenida en el gas se disipe mediante una onda de choque. A alta presión porque significa que en el instante de la liberación de la presión del gas es superior a la de la atmósfera circundante.
Una explosión puede resultar de una sobre presión de un contenedor o estructura por medios físicos (rotura de un globo), medios fisicoquímicos ( explosión de una caldera) o una reacción química (combustión de una mezcla de gas).
|
Clasificación de las explosiones por su origen
|
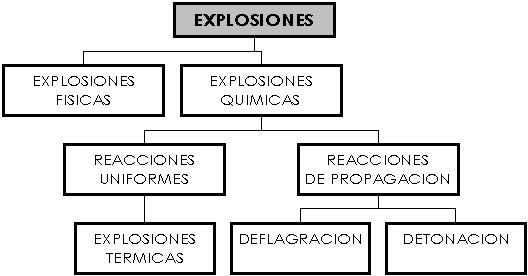
La diferencia fundamental entre las explosiones causadas por un gas a alta presión se debe al origen de las mismas. A continuación mostramos un cuadro con la clasificación:
|
EXPLOSIONES FÍSICAS
|
En determinados casos el gas alta presión se genera por medios mecánicos o por fenómenos sin presencia de un cambio fundamental en la sustancia química. Es decir alcanza presión mecánicamente, por aporte de calor a gases, líquidos o sólidos o bien el sobrecalentamiento de un líquido puede originar una explosión por medios mecánicos debido a la evaporación repentina del mismo. Ninguno de estos fenómenos significa cambio en la sustancia química de las sustancias involucradas. Todo el procesos de generación de alta presión, descarga y efectos de la explosión puede entenderse de acuerdo a las leyes fundamentales de la física.
La mayor parte de la explosiones físicas involucran a un contenedor tal como calderas, cilindros de gas, compresores, etc. En el contenedor se genera alta presión por compresión mecánica de gas, calentamiento del contenido o introducción de otro gas a elevada presión desde otro contenedor. Cuando la presión alcanza el límite de resistencia de la parte más débil del contenedor se produce el fallo. Los daños generados dependen básicamente del modo de fallo. Si fallan pequeños elementos pero el contenedor permanece prácticamente intacto, la metralla proyectada resulta peligrosa como balas, pero la descarga de gas es direccional y controlada en esta condiciones los daños causados se limitan a penetración de metrallas, quemaduras y otros efectos dañinos por gases calientes.
Cuando el fallo ocurre en las paredes del contenedor se producen proyecciones de metrallas de mayor tamaño provocando un violento empuje de la estructura del contenedor en la dirección opuesta a la descarga del gas. En este caso la liberación del gas es extremadamente rápida y genera una violenta onda de choque.
En el caso de que el contendor almacene un líquido sobrecalentado (líquido a temperatura superior a su punto de ebullición o un gas licuado como amoníaco o dióxido de carbono) cuando el contenedor se rompa se producirá súbita evaporación del líquido. El volumen evaporado es suficiente como para enfriar el producto liberado hasta su punto de ebullición y aumentar los efectos de la presión. Este fenómeno se conoce como BLEVE (explosión de vapor en expansión de un líquido en ebullición).
Otro fenómeno es la evaporación de un líquido puesto en contacto con otra sustancia a una temperatura muy por encima del punto de ebullición del líquido. Este es el caso de la introducción de agua de tubos de calderas, cómo intercambiadores de calor o tanques de fluidos de transferencia de calor, a alta temperatura pueden provocar violentas explosiones.
|
EXPLOSIONES QUIMICAS
|
En otros casos la generación del gas a alta presión resulta de la reacción química de un producto donde la naturaleza del mismo difiere de la inicial (reactivo), La reacción química más común presente en la explosiones es la combustión, dónde un combustible (por ejemplo metano) se mezcla con el aire, se inflama y arde generando dióxido de carbono, vapor de agua y otros subproductos hay otras reacciones químicas que generan gases a alta presión.
Las explosiones resultan de la descomposiciones de sustancias puras, detonación, combustión, hidratación, corrosión y distintas interacciones de más o más sustancias químicas. Cualquier reacción química puede provocar una explosión si se emiten productos gaseosos, si se evaporizan sustancias ajenas por el calor liberado en la reacción o si se eleva la temperatura de gases presente, por la energía liberada.
La reacción química más conocida que produce gases a alta presión por medio de otros gases o vapores, en la combustión de gases en el aire sin embargo otros gases oxidantes cómo el oxígeno, cloro, fluor, etc. Pueden ser sustituidos por algo, produciendo con frecuencia procesos de combustión muchos más intensos.
Los polvos y nebulizadores ( líquidos en estado pulverizado) pueden generar, al quemarse en el aire o en otro medio gaseoso reactivo, gases a elevada presión. La combustión puede producirse con cualquier partícula, pero en la práctica de mayores riesgos se encuentran en las de 840 micras o menos. A medida que disminuye el tamaño más fácil se produce la dispersión y más estable y duradera resulta. Las partículas más finamente definida implica mayor riesgo al facilitar la formación de dispersiones, mantenerlas durante más tiempo y quemarse más rápidamente las partículas de mayor tamaño.
Las reacciones químicas pueden clasificarse en uniformes que son transformaciones químicas que involucran toda la masa reactiva y reacciones de propagación, en la que existe un frente de reacción, claramente definido que separa el material sin reacción de los productos de la reacción, avanzando a través de toda la masa reactiva.
![]() REACCIONES UNIFORMES: En este tipo de reacciones la velocidad sólo depende de la temperatura y la concentración de los agentes de la reacción manteniéndose constante en toda la masa reactiva. A medida que aumenta la temperatura de la masa la reacción se acelera alcanzando el punto de calentamiento en el que el calor generado supera al disipado por al ambiente por la masa. Puesto que se genera calor en toda la masa reactiva, pero disipa más lentamente desde el centro que desde la superficie exterior el centro se calienta más y aumenta su velocidad de reacción.
REACCIONES UNIFORMES: En este tipo de reacciones la velocidad sólo depende de la temperatura y la concentración de los agentes de la reacción manteniéndose constante en toda la masa reactiva. A medida que aumenta la temperatura de la masa la reacción se acelera alcanzando el punto de calentamiento en el que el calor generado supera al disipado por al ambiente por la masa. Puesto que se genera calor en toda la masa reactiva, pero disipa más lentamente desde el centro que desde la superficie exterior el centro se calienta más y aumenta su velocidad de reacción.
![]() REACCIONES DE PROPAGACIONES: Una mezcla de hidrógeno y oxígeno puede almacenar a temperatura ambiente durante extensos períodos de tiempo sin indicios de reacciones químicas. No obstante la mayoría de estas mezclas reaccionan violentamente si se aplica una fuente de ignición. La reacción comienza en dicha fuente y se propaga por la mezcla. Pueden diferenciarse tres zonas distintas la zona de reacción, la zona de producto (detrás de la llama) y la zona sin reacción (frente a la llama). Una reacción de propagación siempre es exotérmica. La reacción se inicia con una zona relativamente pequeña de alta temperatura, generada por un encendedor externo o por acumulación de calor en el núcleo de un sistema de reacción uniforme. Para que la reacción se propague, el núcleo, activado por el inflamador, debe elevar suficientemente la temperatura del material circundante de forma que entre en reacción. Cuanto más elevada sea la temperatura inicial del sistema, más fácilmente se inflama y más probable resulta la reacción de propagación, puesto que se requiere menos transmisión de energía para que entre en reacción el material circundante. Puesto que una reacción de propagación se inicia en un punto específico y se propaga a través de la masa reactiva, la velocidad de disipación depende de la propagación del frente de reacción. Las velocidades de propagación varían desde cero a varias veces la velocidad del sonido, dependiendo de la composición, temperatura, presión, grado de confinamiento y otros factores.
REACCIONES DE PROPAGACIONES: Una mezcla de hidrógeno y oxígeno puede almacenar a temperatura ambiente durante extensos períodos de tiempo sin indicios de reacciones químicas. No obstante la mayoría de estas mezclas reaccionan violentamente si se aplica una fuente de ignición. La reacción comienza en dicha fuente y se propaga por la mezcla. Pueden diferenciarse tres zonas distintas la zona de reacción, la zona de producto (detrás de la llama) y la zona sin reacción (frente a la llama). Una reacción de propagación siempre es exotérmica. La reacción se inicia con una zona relativamente pequeña de alta temperatura, generada por un encendedor externo o por acumulación de calor en el núcleo de un sistema de reacción uniforme. Para que la reacción se propague, el núcleo, activado por el inflamador, debe elevar suficientemente la temperatura del material circundante de forma que entre en reacción. Cuanto más elevada sea la temperatura inicial del sistema, más fácilmente se inflama y más probable resulta la reacción de propagación, puesto que se requiere menos transmisión de energía para que entre en reacción el material circundante. Puesto que una reacción de propagación se inicia en un punto específico y se propaga a través de la masa reactiva, la velocidad de disipación depende de la propagación del frente de reacción. Las velocidades de propagación varían desde cero a varias veces la velocidad del sonido, dependiendo de la composición, temperatura, presión, grado de confinamiento y otros factores.