Descomposición catalítica heterogénea de óxido nitroso – 1º Parte
El óxido nitroso se considera actualmente un contaminante atmosférico porque contribuye a la destrucción del ozono estratosférico y al efecto invernadero [1]. El incremento de este contaminante se atribuye a actividades antropogénicas, tales como: uso de fertilizantes, combustión de biomasa, uso de lechos fluidificados para combustión, emisiones vehiculares, y producción de ácido adípico para la obtención de Nylon, entre otros [2]. Además de las fuentes conocidas hay otras no identificadas: la regeneración de catalizadores de craqueo catalítico, la destrucción oxidativa de compuestos orgánicos volátiles, la oxidación de amoníaco y otros procesos que usan ácido nítrico para oxidación, tales como: procesamiento de minerales, pulimento de superficies metálicas, e incluso procesos de preparación de catalizadores donde se usa ácido nítrico o nitratos [3].
El óxido nitroso también se forma como consecuencia de las medidas de control en la emisión de otras especies ambientalmente dañinas [3]. Por ejemplo, en la reducción catalítica no selectiva de NOx con HCN o con úrea, así como en los catalizadores de tres vías envejecidos. Aparte de disminuir el óxido nitroso global, la descomposición de N2O es también una aplicación local importante en cuartos de anestesia, en el reprocesamiento de combustibles radioactivos con ácido nítrico y en la producción de aire respirable para los astronautas, entre otras.
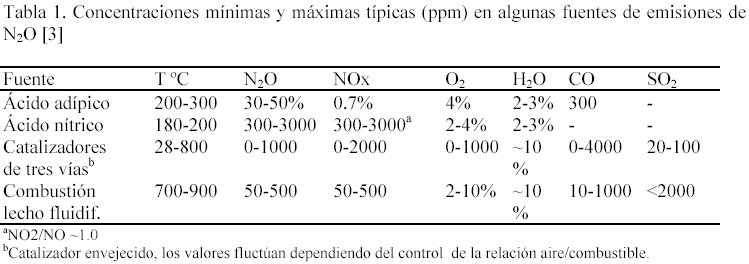
Aunque en la actualidad no existe legislación con relación a las emisiones de N2O, se nota mayor preocupación de los gobiernos sobre el impacto de éste compuesto [3]. El tiempo de vida medio del óxido nitroso es de 150-160 años [2]. Por lo tanto, el efecto en la disminución de las emisiones actuales sólo se observará después de muchas décadas. Se ha estimado que a fin de estabilizar la concentración de óxido nitroso en la atmósfera se requiere disminuir las emisiones antropogénicas en un 70-80% [2]. Las técnicas de control dependerán de la fuente. La tabla 1 presenta valores típicos de algunas fuentes [3].
La catálisis ofrece una alternativa para disminuir las emisiones de N2O, ya sea mejorando las selectividades de los catalizadores utilizados en los procesos donde se produce este contaminante, por descomposición directa o reducción del N2O. No obstante, la mayoría de las técnicas de disminución de N2O están todavía en la etapa de desarrollo. En este documento se presenta una revisión de los sistemas catalíticos reportados últimamente para la descomposición de N2O.
|
FUNDAMENTOS TEORICOS [3]
|
La molécula de N2O es muy estable a temperatura ambiente. En la molécula asimétrica N-N-O el orden del enlace N-N es de 2.7 y el de N-O alrededor de 1.6. Por lo tanto, este último es el más probable de romper primero. La energía de activación para la fisión térmica del enlace N-O es alrededor de 250-270 KJ/mol y se requieren temperaturas superiores a los 900 K para alcanzar conversión significativa de acuerdo a la ecuación:
![]()
La principal acción catalítica puede originarse mediante la donación de carga a los orbitales antienlace, debilitando el enlace N-O y bajando la energía de activación y la temperatura de reacción. La adición de agentes reductores, como H2, CO, hidrocarburos y carbón, también contribuye a la eliminación de N2O. Este comportamiento es paralelo a la función que desempeña el N2O como un intermedio en la Reducción Catalítica Selectiva de NO con hidrocarburos en presencia de oxígeno.
![]()
Dependiendo de las propiedades de los catalizadores pueden ocurrir otras reacciones debido a la presencia de otros gases en los efluentes. Por ejemplo:
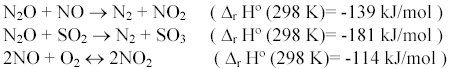
Adicionalmente, cuando las concentraciones de N2O son muy altas la temperatura se puede incrementar, imponiendo demandas en la estabilidad térmica del catalizador.
|
|
Los catalizadores para disminuir las emisiones de N2O, deben satisfacer los requerimientos de alta actividad y estabilidad en las condiciones de aplicación. Es decir baja sensibilidad a la presencia de oxígeno y a la inhibición por H2O, tolerancia a venenos como SO2 y estabilidad térmica. En combustores de lecho fluidificado el catalizador debe también ser resistente a la atrición. Adicionalmente, en todas las aplicaciones es necesario que la caída de presión sea baja. Las altas velocidades de flujo involucradas requieren generalmente el uso de estructuras monolíticas [4], aunque se están desarrollando estructuras de lecho empacado de baja caída de presión [3].
Las reacciones involucradas en la destrucción de N2O son exotérmicas, de tal manera que la estabilidad térmica del catalizador es importante principalmente en plantas de ácido adípico donde se encuentran altos niveles de concentración de N2O. Los niveles típicos de 30-50% (Tabla 1) de N2O conducen a temperatura adiabáticas entre 500-700 K. En las reacciones donde se usan agentes reductores, la temperatura se incrementará más. El control de esta exoterma es un factor notable en el diseño. Los niveles de concentración mucho más bajos en otras fuentes limitan la elevación de la temperatura adiabática a menos de 10 K [3]. A continuación se presentan algunas tecnologías en desarrollo para fuentes específicas.
Plantas de ácido adípico
Los productores de ácido adípico (DuPont, ASAHI, BASF, Bayer and Rhone-Poulenc) establecieron una especie de cooperación para desarrollar procesos conducentes a la disminución de las emisiones de N2O, con miras a implementarlos en 1998 [5]. DuPont y UOP desarrollaron un proceso catalítico para descomponer N2O en los gases de salida de las plantas de ácido adípico [6]. El catalizador de propiedad de UOP está basado en un sistema binario de óxidos que no es demasiado sensitivo a la presencia de oxígeno. Además, con la adición de algunos metales preciosos se disminuyen las temperaturas a las cuales se obtienen conversiones superiores al 50%. Debido a la producción de calor a altas concentraciones la reacción tiene un comportamiento autocatalítico. En un lecho empacado se tratan concentraciones de N2O>5%, mientras que en forma monolítica se pueden usar concentraciones de N2O>15%. Esto último se debe a la menor densidad de catalizador en combinación con mayor transferencia de calor [4]. El catalizador desarrrollado por DuPont [7] es CoO/NiO sobre ZrO2 el cual necesita temperaturas por encima de 280ºC para dar conversiones significativas. Los productores de ácido adípico BASF y ASAHI proponen el catalizador Cu/Al2O3 para la descomposición catalítica de N2O.
Otras actividades de DuPont, en cooperación con empresas como Rhone Poulenc y EER incluyen el desarrollo de un proceso para reoxidar el N2O a NO el cual es reciclable para producir ácido nítrico. Se producen alrededor de 0.15 moles de NO por mol de N2O [5,7-8]. Una tercera alternativa es usarlo como un agente oxidante selectivo. Entre los ejemplos encontrados en la literatura se encuentran: la oxidación de benceno a fenol, metano a metanol, metanal o gas de síntesis, etano o eteno a etanol o etanal, propeno a propanal y transformación oxidativa de metano. En especial la oxidación de aromáticos a fenoles usando zeolitas parece atractivo [3].
Consuelo Montes de Correa
Departamento de Ingeniería Química , Universidad de Antioquia
Fax (574) 263 82 82, email: [email protected]