Análisis de riesgo sanitario en aguas grises de la Provincia de Buenos Aires, Argentina
RESUMEN
Las aguas grises pueden definirse como los efluentes domiciliarios provenientes de cocina, duchas y lavaderos cuando se disponen de manera separada a las aguas que contienen materia fecal denominadas aguas negras. Las aguas grises presentan riesgos de transmisión de enfermedades debido a que pueden transportar un número limitado pero importante de microorganismos patógenos. En muchas zonas las aguas grises se eliminan en zanjas a cielo abierto, lo que genera un riesgo para los habitantes de zonas urbanizadas de Argentina que no ha sido adecuadamente analizado. El objetivo de este estudio fue evaluar el riesgo sanitario, a través de un análisis cuantitativo de riesgo microbiológico (ACRM) de aguas grises crudas, sometidas a procesos de sedimentación y filtración a través de septos de arena. Los microorganismos indicadores se detectaron en todas las muestrasanalizadas. Los recuentos mayores correspondieron a coliformes totales. Se determinó la presencia de Salmonella spp. en el 20 % de las muestras. El mayor riesgo de infección por una sola exposición resultó de una ingesta accidental de 0.01 a 0.1 g de tierra, donde la probabilidad de contraer una infección con E. coli fue de 7.4 × 10–2. Con respecto al agua gris tratada se observó que al filtrarla, disminuyó el riesgo para E. coli de 7.4 × 10–2 a 4.2 × 10–5.
INTRODUCCIÓN
Puede definirse al agua gris como el líquido residual domiciliario proveniente de duchas, máquinas de lavar, piletas, etcétera (Gross et al. 2007). La calidad del agua gris depende de las actividades de la población que la origina y de su procedencia. Este líquido residual contiene jabón, detergentes, shampoo, aceites, grasas y diversas sustancias químicas. La contaminación más significativa proviene de los detergentes. En este tipo de agua también puede encontrarse bacterias, parásitos y virus aportados por el agua de ducha, lavaderos y fregaderos. Si bien el agua gris contiene menor contaminación fecal que los líquidos del alcantarillado, ambos fluidos residuales representan un riesgo para la salud humana tanto por la presencia de compuestos químicos como de microorganismos patógenos (Lucke 2003).
Los indicadores bacterianos o coliformes fecales en aguas grises exhiben gran variabilidad, las concentraciones detectadas van desde 0 a 107 unidades formadoras de colonias (ufc) en 100 mL (Ottoson y Stentrom 2003, Friedler et al. 2006). Bacterias enteropatógenas, como Escherichia coli y distintas especies de Shigella, Salmonella y Campylobacter, entre otras, pueden estar presentes en las aguas grises aportadas por las piletas de las cocinas o por contaminación fecal cruzada al lavar telas contaminadas como pañales (Rose et al. 1991). En Inglaterra Birk et al. (2007) observaron la presencia de Salmonella veltereden y Giardia sp. en aguas grises provenientes de duchas y lavabos. Hacen falta estudios que determinen las cargas microbianas y que caractericen los patógenos de aguas grises en Argentina.
La eliminación y disposición final de las aguas originadas por las actividades domésticas constituye un importante problema sanitario en zonas urbanas densamente pobladas. En Argentina, como en muchos países de Latinoamérica, gran parte de la población carece de redes de alcantarillado. En estos casos se recurre a sistemas de eliminación diferenciada, en la que se deriva las aguas negras hacia pozos ciegos, cuya capacidad para recibir efluentes es limitada. En tanto que las aguas grises, que presentan un mayor volumen que las anteriores, son enviadas a canales a cielo abierto. Estos pequeños canales, generalmente improvisados, corren entre la acera y la calzada y se unen para formar canales colectores de mayor tamaño que desembocan en arroyos o ríos.
El riesgo que presentan las aguas grises no tratadas no ha sido convenientemente estimado actuamente en el país. Complejas cuestiones socioeconómicas y políticas hacen que la construcción y operación de redes de alcantarillado y de plantas para tratamiento de efluentes urbanos no puedan llevarse a cabo en un futuro cercano en áreas cuya población crece rápidamente. Mientras una solución definitiva a estos problemas pueda aplicarse existen alternativas destinadas a minimizar los riesgos para las poblaciones expuestas. Algunos autores como Ottosson (2003) y Stevik et al. (1999) han propuesto procedimientos muy sencillos y de bajo costo para disminuir la carga microbiana de estas aguas antes de su disposición final.
La evaluación de riesgo implica la caracterización cualitativa o cuantitativa de los posibles efectos adversos para la salud asociados con la exposición de las personas a un peligro químico o biológico. En particular el análisis cuantitativo de riesgo microbiológico (ACRM) puede utilizarse para avalar la toma de decisiones referidas al saneamiento ambiental, con lo que se podrían evitar costosos estudios epidemiológicos (Craig et al. 2003, Ottosson 2003). E. coli presenta un amplio conjunto de serotipos entre los cuales sólo algunos son responsables de causar enteritis en humanos. Estos serotipos han sido clasificados en seis categorías o grupos: enterohemorrágica, enteropatógena, enterotoxigénica, enteroinvasiva, enteroagregativa y de adherencia difusa (DAEC). En la Argentina el síndrome urémico hemolítico es endémico, con aproximadamente 300 nuevos casos reportados anualmente por las unidades hospitalarias de nefrología (Meichtri et al. 2004). Estudios realizados por Esquivel et al. (2010) determinaron una prevalencia del 31 % en pacientes con diarrea aguda. Se aisló E. coli O157:H7 (este serotipo pertenece al grupo enterohemorrágico) en el Río de La Plata, en áreas cercanas a las tomas de agua de los centros de purificación para el consumo humano (López et al. 1998). En la Argentina, según el Boletín epidemiológico periódico (2006), la infección por Salmonella spp. constituye una de las enfermedades zoonóticas más importantes para la salud pública. Anselmo et al. (1999) observaron un elevado porcentaje de aislamientos positivos de Salmonella en muestras del Río Luján.
El objetivo de este estudio fue evaluar el riesgo sanitario, a través de un análisis cuantitativo de riesgo microbiológico (ACRM) de aguas grises crudas y sometidas a procesos de sedimentación y filtración por septos de arena.
MATERIALES Y MÉTODOS
Área de estudio
Para realizar este estudio se eligió una zona de Ingeniero Budge, Lomas de Zamora, Provincia de Buenos Aires, Argentina que cuenta con más de 40 000 habitantes en urbanizaciones de aproximadamente 30 a 40 años de antigüedad (Fig. 1). Esta zona fue seleccionada por presentar una característica de eliminación de aguas grises similares a muchas otras de la región. Los canales a cielo abierto que drenan las aguas grises hacia otros canales mayores que a su vez desembocan en la cuenca Matanza Riachuelo, están construidos en terrenos bajo la cota del río colector principal de la cuenca. Como consecuencia, el desagüe es difícil. Durante la temporada de lluvias los canales se desbordan cubriendo las zonas habitables de casas y aceras.
 |
Muestreo
Se tomaron diez muestras en total entre mayo de 2008 y abril de 2009 en un sólo sitio de muestreo del canal Figueredo en Ingeniero Budge, Provincia de Buenos Aires. La toma de muestra se realizó en recipientes estériles de 20 L a una profundidad de 50 cm de acuerdo con los métodos estándar (APHA et al. 2012). Una vez tomadas las muestras, se conservaron refrigeradas a 4 ºC y se procesaron el mismo día de la toma de muestra.
Dentro de las 12 h siguientes se llevó a cabo el análisis microbiológico. Primero las muestras se dejaron reposar para que se realizara la sedimentación espontánea en bandejas de 15 L de capacidad donde se dispusieron 4 L de agua gris durante 96 h a temperatura ambiente simulando las condiciones de permanencia del agua en los canales (Henry y Heinke 1999). Transcurrido el periodo de sedimentación se realizó la filtración por arena.
Para el proceso de filtrado de las muestras de agua gris se utilizó una columna de acrílico con un diámetro de 15 cm y una altura de 100 cm, que se rellenó hasta una altura de 80 cm con arena previamente lavada con agua destilada y esterilizada. Las partículas de la arena utilizada tenían la siguiente distribución de tamaño: 70 % en un rango de 0.25 – 0.10 mm y 30 % en un rango de 0.50 – 0.25 mm. La columna fue cargada intermitentemente con 60 mm de agua gris por día aplicada en 12 dosis (Stevic et al. 1999).
Análisis microbiológico
Se tomaron alícuotas de las muestras y se prepararon diluciones decimales seriadas de 10-1a 10-4 en solución fisiológica.
Las cajas de Petri fueron inoculadas con 1 mL de la muestra en en un medio de cultivo de 15 mL de Agar CHROMagar ECC (CHROMagar) a 40 ºC, las que fueron homogeneizadas por rotación, técnica conocida como siembra en microaerofilia. Posteriormente, las cajas de Petri se incubaron 48 h a 44 ºC para determinar las unidades formadoras de colonias (ufc) de coliformes fecales y de Escherichia coli.
Se sembró, en microaerofilia, 1 mL de las diluciones efectuadas en Agar selectivo para enterococos Slanetz Bartley (Biokar) y se incubaron durante 48 h a 35 ºC con el propósito de determinar las unidades formadoras de colonias (ufc) de enterococos (Goméz et al. 2007).
Para determinar la presencia de Salmonella spp. se utilizó la técnica del número más probable (NMP) descrita por la Agencia de Protección Ambiental de los EUA (EPA, por sus siglas in inglés; método 1682) para Salmonella en biosólidos modificada: se inocularon series de cinco tubos de caldo soya tripticaseína y se dejaron incubar por 24 h a 35 ºC. Los tubos con crecimiento se sembraron en caldo tetrationato (Biokar) y caldo Rappaport-Vassiliadis (Biokar) y se incubaron durante 18 h a 35 y a 44 ºC respectivamente. Después de la incubación se realizó el aislamiento en cajas de Petri con agar xilosa-lisinadeoxicolato (XLD; Biokar) que se incubaron 48 h a 37 ºC. Las colonias características se sembraron en los siguientes medios: triple azúcar hierro (TSI; Biokar), lisina hierro agar (LIA; Britania) y caldo urea (Britania). La identificación se realizó mediante el índice analítico de perfil (API, por sus siglas en inglés) 20E (Biomerieux).
Análisis cuantitativo de riesgo microbiológico (ACRM)
Se realizó un análisis de Montecarlo para entender la gama de posibles riesgos de infección dadas las distribuciones probables de los valores de los parámetros utilizados en el modelo.
Para calcular el riesgo de infección para ambos patógenos se utilizó el modelo de beta – Poisson.
Pi = 1- [1+ (d/ ID50) (21/α– 1)]–α
Pi = probabilidad de infección
d = dosis
ID50 = dosis infectiva mínima
α = parámetro de la curva dosis-respuesta.
Para E. coli enteropatógena: ID50 = 5.9 x 105
α = 0.49
(Hass et al. 1999)
Para Salmonella spp: ID= 23.600 α = 0.3126
Para el riesgo anual se asume que x exposiciones
al año:
PInf;anual = 1-[1 – Pi ]FE
FE = frecuencia de exposición en cada escenario
Dos diferentes escenarios de exposición se plantearon para calcular el riesgo microbiológico.
A. Ingestión accidental de 0.01 a 0.1 g de tierra en una sóla exposición por parte de niños que jueguen en el lugar (96 días al año). La cantidad de tierra ingerida involuntariamente se considera que es no mayor a 0.1 g por persona y por exposición (Haas et al. 1999, WHO 2001). Se asume que el número de bacterias en 100 mL de agua gris es equivalente al número de bacterias en 100 g de tierra (Mara et al. 2007). B. Ingestión accidental de agua del canal por
salpicadura: 10 mL de agua (48 días al año; Donovan et al. 2008).
Para ambos escenarios se estimó la disminución del riesgo después de realizar la sedimentación y la filtración según los datos experimentales obtenidos.
El riesgo de infección por una sola exposición, se calcula asumiendo:
1. Un modelo dosis-respuesta para Escherichia coli enteropatógena, considerando que el 8 % de la cantidad de E. coli detectada es enteropátogena (Haas et al. 1999, Howard et al. 2006, Diallo et al. 2008).
La cantidad de E. coli se estimó por el método de Montecarlo a partir de los datos experimentales. Una distribución log normal resultó adecuada (P = 0.94).
El volumen ingerido también fue estimado en los dos escenarios, para el A se consideró una distribución uniforme en (10 mL, 100mL) y para el B una distribución triangular con moda en 10 y rango 7.5 – 12.5.
La cantidad total de iteraciones fue de 10 000. A partir de las iteraciones se estimó el riesgo medio para una ingesta y su correspondiente intervalo de confianza (95 %), al igual que para la ingesta anual.
2. Un modelo dosis-respuesta para Salmonella spp. Para estimar la concentración de Salmonella se utiliza normalmente la relación Salmonellacoliformes fecales (Hass et al. 1999). Se estimó la cantidad de coliformes fecales por el método de
Montecarlo a partir de los datos experimentales. Una distribución log normal resultó adecuada (P = 0.40).
La cantidad de Salmonella presente fue estimada considerando una distribución triangular según la relación obtenida empíricamente. El volumen ingerido fue estimado con las mismas distribuciones especificadas para E. coli. La cantidad total de iteraciones fue de 10 000. A partir de las iteraciones se estimó el riesgo medio para una ingesta y su correspondiente intervalo de confianza (95 %), al igual que para la ingesta anual.
Análisis estadístico
Para comparar los recuentos de las bacterias indicadoras en los meses de muestreo se utilizó la prueba de Mann-Whitney. Para explicar la dispersión de los datos se calculó el coeficiente de variación.
RESULTADOS Y DISCUSIÓN
Análisis microbiológico
En la figura 2 se presentan los valores medios de las concentraciones de las bacterias indicadoras de contaminación fecal. Los valores de E. coli varían de 1.6 × 105 a 2.5 × 106ufc/100 mL, con un valor medio de 5.3 × 105 ufc/100 mL. Con respecto a enterococos, los recuentos varían de 1.4 × 105 a 2.0 × 106ufc/100 mL, con un valor medio de 3.2 × 105 ufc/100 mL.
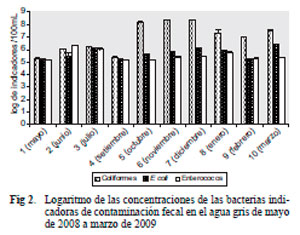 |
Los microorganismos indicadores estuvieron presentes en todas las muestras analizadas. Se detectó un aumento de los coliformes totales de más de dos órdenes logarítmicos de magnitud desde octubre en adelante con una diferencia significativa con respecto a los meses anteriores (P =0.03). En cambio, esto no se observó en los recuentos de E. coli y enterococos, donde las diferencias no fueron significativas (P = 0.7 y 0.8 respectivamente). Al analizar la dispersión de las concentraciones de los indicadores, los coliformes mostraron una mayor variabilidad en los datos que los enterococos y E. coli, lo que es evidente por el valor de casi 25 % en el coeficiente de variación de los coliformes, y el 11 % para las otras dos bacterias indicadoras.
Birks et al. (2007) determinaron que la concentración media de E. coli fue de 3.9 × 105 ufc /100 mL y los valores medios de coliformes totales fueron de 2.2 × 107 ufc /100 mL, datos similares a los obtenidos en este trabajo. En cambio, los recuentos de enterococos detectados por otros autores estuvieron entre 1 y 2 órdenes logarítmicos más bajos que los observados en este estudio (Otosson y Stenström 2003, Birks et al. 2007). Por otra parte Winward et al. (2008) al analizar agua gris proveniente de duchas y lavabos, obtuvieron recuentos de E. coli y enterococos 100 veces menores de los detectados en las muestras estudiadas en este trabajo.
Los valores hallados en los recuentos de coliformes totales, E. coli y enterococos indican la presencia de contaminación fecal en las aguas grises, con posible presencia de enteropatógenos (Birk et al. 2007).
Se detectó Salmonella spp. por NMP en el 20 % de las muestras con valores bajos entre 2 y 1/100 mL en los meses de diciembre y octubre.
Pasado el tiempo de sedimentación de 96 h, en el agua gris se observó una reducción de un orden logarítmico para las bacterias indicadoras. Esto se debe probablemente a que las partículas más grandes al sedimentar eliminaron microrganismos por adsorción (Ottosson 2003). En ninguna de las muestras de agua procesadas después de la sedimentación se detectó Salmonella spp.
Luego de la filtración por columna de arena el número de bacterias indicadoras se redujo entre 1.64 y 3.87 órdenes logarítmicos. Aunque las concentraciones de E. coli y de enterococos fueron similares en el agua gris cruda, en las muestras de agua filtrada se observó una mayor reducción en el número de enterococos (3.87 log). Gross et al. (2007) mostraron que podía disminuir la población de E. coli en 4.6 órdenes logarítmicos al pasar un agua gris artificial por filtración vertical a través de arena. Otros autores encontraron que la materia orgánica y las sustancias tensoactivas presentes en el agua gris influían en la eficacia del proceso de filtración (Powelson y Mills 1998, Stevick et al. 2004,).
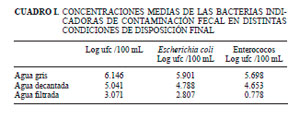
En el presente estudio la sedimentación seguida de filtración logró una reducción de 3.09 órdenes logarítmicos para E. coli y de 4.92 órdenes logarítmicos para enterococos (Cuadro I). De acuerdo con las normas de la Organización Mundial de la Salud (OMS),
 |
estos líquidos residuales podrían utilizarse para el riego restringido (WHO 2000).
Las temperaturas promedio en los meses estudiados fueron la máxima de 24 ºC y la mínima de 15 ºC.Los meses de mayores precipitaciones fueron febrero y marzo con un promedio de 77 mm. No se observó correlación entre las condiciones ambientales (temperatura o lluvias) y los recuentos de bacterias indicadoras.
Evaluación de riesgo
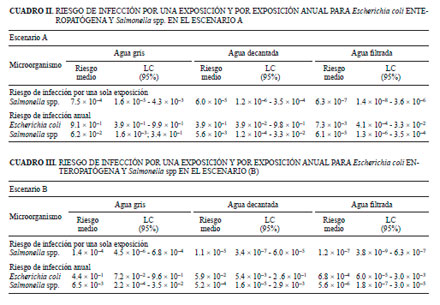
Los cuadros II y III muestran los valores de riesgo de infección con Salmonella spp. y E. coli enteropatógena para una sóla exposición y para una exposición anual en los escenarios A y B respectivamente.
El mayor riesgo de infección estimado en una sola exposición fue para E. coli enteropatógena (7.4 × 10–2). Para el cálculo del riesgo de infección con E. coli enteropatógena se estimó la presencia de la misma de acuerdo con Haas et al. (1999), Howard et al. (2006) y Diallo et al. (2008) quienes determinaron que un 8 % del número de E. coli detectadas en ambientes acuáticos, similares a los estudiados en este caso, corresponden a cepas enteropatógenas.
Por ello los valores medios obtenidos de E. coli se multiplicaron por 0.08 para obtener la evaluación del riesgo a partir este agente.
Es importante señalar que el desarrollo de una enfermedad después de la infección depende de la respuesta inmune de cada individuo. El riesgo para E. coli enteropatógena es mayor que para Salmonella spp. debido principalmente a las diferencias en las ecuaciones de dosis-respuesta y a la mediana de las dosis infecciosas.
El escenario A presenta un mayor riesgo que el B. Los niños presentan un mayor riesgo de transmisión de agentes patógenos pues están más expuestos al ambiente y en muchos casos no desarrollaron aún buenos hábitos como el lavado frecuente de manos. Además durante las actividades recreativas pueden ingerir mayores cantidades de polvo y agua (Nwachuku y Gerba 2004).
Diallo et al. (2008) calcularon un riesgo anual de infección por E. coli enteropatógena de 0.07 en canales con agua contaminada con aguas residuales, riesgo menor al obtenido en las aguas grises analizadas en este trabajo. Ottoson et al. (2003) al calcular el riesgo microbiológico en aguas grises determinaron un valor de riesgo de 10–2 para Salmonella spp., similar al escenario A del presente trabajo. Al tratar el agua los autores antes mencionados demostraron una disminución de riesgo a valores de 10–-4.
 |
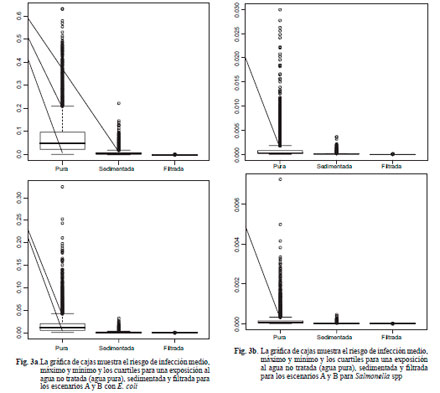 |
Con respecto al agua gris filtrada se observó que el riesgo para una sóla exposición, tanto para E. coli enteropatógena como para Salmonella spp. es 1000 veces menor. En la figura 3a se pone de manifiesto la reducción del riesgo con E. coli en el agua filtrada, no sólo en su valor medio sino también en su variabilidad. En efecto, para el escenario A el riesgo mediano disminuye de 7.4 × 10–2 a 4.2 × 10–5 y el rango intercuartil en el agua cruda se reduce de 7.5 × 10–2 a 7.0 × 10–5. Para el escenario B el riesgo mediano disminuye de 1.0 × 10–2 a 8.7 × 10–6 y el rango intercuartil en el agua cruda se reduce de 1.5 × 10–2 a 1.3 × 10–5.
En la figura 3b también se observa una reducción del riesgo para Salmonella spp. Para el escenario A el riesgo mediano disminuye de 3 × 10–-4a 2.5 × 10–7 y el rango intercuartil en el agua cruda se reduce de 6.5 × 10–-4a 5.5 × 10–7. Para el escenario B el riesgo mediano disminuye de 6.3 × 10–5 a 5.3 × 10–8 y el rango intercuartil en el agua cruda se reduce de 1.2 × 10–-4a 1.0 × 10–7.
En ambos escenarios para E. coli se observa que el riesgo anual en el agua cruda alcanza valores promedio y medianos superiores al riesgo aceptado por la EPA (8 × 10–3), mientras los valores del agua filtrada resultan inferiores a dicho indicador.
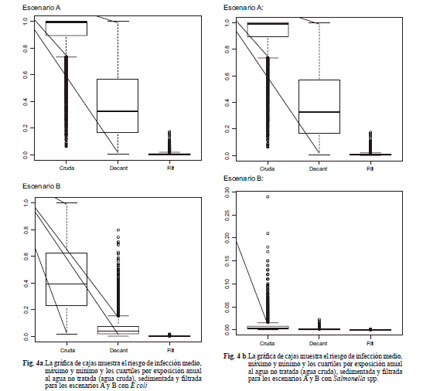 |
En el escenario A al comparar el agua cruda con la filtrada, el riesgo pasa de valores del orden de 10–-1a valores del orden de 10–3
En el mismo orden de disminución se encuentra la variabilidad medida a través del rango intercuartil. Para el escenario B la disminución es aún mayor tanto en los valores medios y medianos, como en la variabilidad ya que las reducciones son desde el orden de 10–-1a valores del orden de 10–-4(Fig. 4a).
Para el caso de Salmonella spp., la reducción en valores medios y la variabilidad en el escenario A son desde un orden de 10–2 en agua cruda a 10–5 en agua filtrada, mientras que en el escenario B la reducción es desde 10–3 a 10–6 (Fig. 4b).
CONCLUSIONES
El ACRM es una herramienta importante para estimar la probabilidad de efectos adversos en los seres humanos y establecer criterios de riesgo sanitario.
La solución definitiva al problema que representa el vertido de aguas grises a la cuenca del Río Matanza Riachuelo es la construcción de una adecuada red de alcantarillado con una planta para el tratamiento de dichos efluentes. La filtración a través de suelos modificados con alto contenido en arenas de las granulometrías indicadas y en las condiciones que se han presentado en este trabajo puede considerarse como una alternativa transitoria dadas las reducciones obtenidas en las evaluaciones de riesgo sanitario. Estas aguas podrían así ser utilizadas en sistemas de riego.
REFERENCIAS
Anselmo R.J., Viora S., Barrios H., Terragno R., Alcaín A. y Caffer M.I. (1999). Serotipos de Salmonella aislados del Río Luján, Argentina. Rev. Latinoam. Microbiol. 41, 77-82
APHA, AWWA y WEF (2012). Standard methods for examination of water and wastewater. 22a ed. American Public Health Association. Washington, EUA. 1496 pp.
Birks R. y Hills S. (2007). Characterization of indicador organisms and pathogens in domestic greywater for recycling. Environ. Monit. Assess. 129, 61-69.
Boletín epidemiológico periódico (2006). Ministerio de Salud. Presidencia dela Nación.30. abril, mayo, junio. Argentina. 30 pp.
Craig D.L., Fallowfield H.J. y Cromar N.J. (2003). Effectiveness of guideline faecal indicator organism values in estimation of exposure risk at recreational coastal sites. Water Sci. Technol. 47, 191-198.
Diallo M.B.C., Anceno A.J., Tawatsupa B., Houpt E.R., Wangsuphachart V. y Shipina O.V. (2008). Infection risk assessment of diarrhea-related pathogens in a tropical canal network. Sci. Total Environ. 407, 223-232.
Donovan E., Unice K., Roberts J.D., Harris M. y Finley B. (2008). Risk of gastrointestinal disease associated within exposure to pathogens in the water of the lower Passaic river. Appl. Environ. Microbiol. 74, 994-1003.
Esquivel P., Lifschitz V., Lösch L.S., Medina M.G., Pato A. M., Cacciamani A. y Merino L.A. (2010). Caracterización
molecular de aislamientos de Escherichia coli productores de diarrea en niños y adultos de la ciudad de Corrientes, Argentina. Rev. Panam. Infectol. 12, 17-21.
Friedler E., Kovalio R. y Ben Zvi A. (2006). Comparative study of microbial quality of greywater treated by three on site treatment systems. Environ. Technol. 27, 653-663.
Gilboa Y. y Friedler E. (2008). UV disinfection of RBCtreated light greywater effluent: Kinetics, survival and regrowth of select microorganisms. Water Res. 42, 1043-1050.
Gómez López M, Araujo Prado M.,.Díaz Díaz M.T, Garrido Vázquez J., Sueiro R., Suárez S. (2007). El tratamiento secundario de aguas residuales como mecanismo redistribuidor de genes de resistencia en bacterias. Hig. Sanid. Ambient. 7, 238-250.
Gross A., Kaplan D. y Baker B. (2007). Renoval of chemical and microbiological contaminants from domestic greywater using a recycled vertical florbiorreactor (RVFB). Ecol. Eng. 31, 107-114.
Haas C.N., Rose J.B. y Gerba C.P. (1999). Quantitative microbial risk assessment. JohnWiley and Sons Inc. Nueva York, E.U.A. 464 pp.
Howard G., Pedley S. y Tibatemwa S. (2006). Quantitative microbial risk assessment to estimate health risks attributable to water supply: can the technique be applied in developing countries with limited data? J.
Water Health. 4, 49-65.
López F., Isequilla P.E. y Kaplan D. (1998). Enfermedades de transmisión hídrica en el Río de La Plata.
Diagnóstico de situación enero-junio 1998. Gobierno de la Ciudad de Buenos Aires 17 pp.
Lucke F.K. (2003). Análisis del riesgo microbiológico en el reciclaje de aguas grises. Memorias. 2º Simposio Internacional sobre Saneamiento Ecológico de la Internacional Water Association. Lübeck Alemania – abril, 2003. Pp. 374-382.
Mara D.D., Sleigh P.A., Blumenthal U.J. y Carr R.M. (2007). Health risks in wastewater irrigation: comparing estimates from quantitative microbial risk analyses and epidemiological studies. J. Water Health. 5, 39-50.
Meichtri L., Miliwebsky E., Gioffré A., Chinen I., Baschkier A., Chillemi G., Guth B.E., Masana M.O., Cataldi
A., Rodríguez H.R. y Rivas M. (2004). Shiga toxinproducing Escherichia coli in healthy young beef steers from Argentina: prevalence and virulence properties.
Int. J. Food Microbiol. 96, 189-198.
Nwachuku N. y Gerba C.P. (2004). Microbial risk assessment: don’t forget the children. Curr. Opin. Microbiol. 7, 206-209.
Ottoson J. (2003). Fecal contamination of greywater- Assesing the treatment required for hygienically safe reuse or discharge. 2º Simposio Internacional sobre Saneamiento Ecológico. pp 1-8. Lubeck, Alemania.
Ottoson J. y Stenstrom T.A. (2003). Faecal contamination of greywater and associated microbial risks. Water Res. 37, 645-655.
Ottosson J. (2003). Hygiene aspects of greywater and greywater reuse. Tesis de licenciatura. Royal Institute of Technology. Estocolmo, Suecia. 50 pp.
Powelson D.K. y Mills A.L. (1998). Water saturation and surfactant effect on bacterial transport in sand columns. Soil Sci. 163, 694-704.
Rose J.B., Sun G.S., Gerba C.P. y Sinclair N.A. (1991). Microbial quality and persistence of enteric pathogens in greywater from various household sources. Water Res. 25, 37-42.
Stevik T.K., Ausland G., Hanssen J.F. y Jenssen P.D. (1999). The influence of physical and chemical factors on the transport of E.coli through biological filters for wastewater purification. Water Res. 33, 3701-3706.
USEPA (1986). Ambient water quality criteria for bacteria.
US EPA A440/5-84−002. Agencia de Protección al Ambiental de los Estados Unidos de América (USEPA). Washington, D.C., EUA.
WHO (2001). Bathing water quality and human health: fecal pollution outcome of an expert consultation. Farnham, Reino Unido. Co-sponsored by Department of the Environment, Transport and the Regions, United Kingdom.Switzerland: World Health Organization. Ginebra, abril de 2001.
Winward G.P., Avery L.M., Frazer-Williams R., Pidou M., Jeffrey P., Stephenson T. y Jefferson B. (2008).
A study of the microbial quality of grey water and an evaluation of treatment technologies for reuse. J. Ecol. Eng. 32, 187-197.
Por: Lidia NUÑEZ, Claudia MOLINARI, Marta PAZ, Carina TORNELLO,
Julián MANTOVANO y Juan MORETTON
Fuente: Revista Internacional de Contaminación Ambiental
VER ARCHIVO DE ARTÍCULO